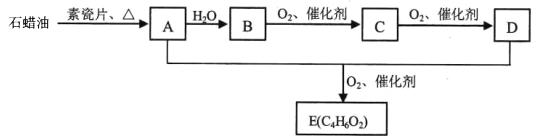
题目内容
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A.1:1
B.2:1
C.1:2
D.3:2
【答案】C
【解析】解:在反应3S+6KOH=2K2S+K2SO3+3H2O中,只有S元素的化合价发生变化,氧化剂和氧化剂都是S,
反应中S→K2S,S化合价降低,则S被还原,S为氧化剂,
S→K2SO3 , S化合价升高,则S被氧化,S为还原剂,
由生成物可知,被氧化与被还原的硫原子数之比为1:2.
故选C.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元紧对应原子的M层电子排布式为________________。
(2)如下图2所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为__________(填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________。
(4)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的熔点比SiO2晶体______(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。

(5)如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;

则:C20分子共有____个正五边形,共有______条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为______(填“有”或“无”)色离子,依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。若实验中大约要使用245mL0.50 mol·L-1NaOH溶液,
(1)配制时至少需要用托盘天平称量NaOH固体_________g。
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,下列说法正确的是_________
A.如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯

B.若用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等
C.中和热测定实验也可以用稀硫酸与氢氧化钡溶液反应
D.为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
(3)写出该反应中和热的热化学方程式:(中和热为ΔH=-57.3 kJ·mol-1)_____________________。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为___________________℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH=________________(取小数点后一位)。
③上述实验数值结果与ΔH=-57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度