题目内容
11.下列对“物质的量”的叙述正确的是( )| A. | 物质的量就是物质的质量 | |
| B. | 物质的量不是国际单位制的七个基本物理量之一 | |
| C. | 物质的量是摩尔的单位 | |
| D. | 阿伏加德罗常数的数值约为6.02×1023 |
分析 A、物质的量是用于衡量一定数目粒子的集合体的物理量;
B、物质的量是七个基本物理量之一;
C、摩尔是物质的量的单位;
D、12g12C中含有的碳原子的个数为阿伏伽德罗常数.
解答 解:A、物质的量是用于衡量一定数目粒子的集合体的物理量,而质量是用于衡量物质轻重的物理量,是两个不同的概念,故A错误;
B、物质的量是七个基本物理量之一,符号为n,单位为mol,故B错误;
C、摩尔是物质的量的单位,符号为mol,故C错误;
D、12g12C中含有的碳原子的个数为阿伏伽德罗常数,数值约为6.02×1023,故D正确.
故选D.
点评 本题考查了物质的量的概念、单位和阿伏伽德罗常数的数值,难度不大,应注意物质的量不是物质的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.用激光柱照射下列分散系时,不能产生丁达尔效应的是( )
| A. | 石灰水 | B. | 稀豆浆 | C. | 云 | D. | Fe(OH)3胶体 |
2.已知2Fe+3Br2═2FeBr3、2Fe3++2I-═2Fe2++I2、4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+现将Fe(NO3)2溶液分别滴入到以下溶液中①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变为Fe3+的是( )
| A. | ①②③④ | B. | 只有②③ | C. | ①②③ | D. | ②③④ |
6.锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.现有一碳素钢锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等,下面是清洗水垢的流程:
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
II.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
III.向洗液中加入Na2SO3溶液;
IV.清洗达标,用NaNO2溶液钝化锅炉.
(1)在步骤I中:
①用NaOH是为了溶解除去水垢中的SiO2,反应的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
②已知:20℃时溶解度/g
根据数据和化学平衡原理解释,加入Na2CO3的作用CaSO4在水中存在平衡CaSO4(s)?Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去.
(2)在步骤II中:
①加入稀盐酸和少量NaF溶液能除掉的水垢是CaCO3、Mg(OH)2、Fe2O3、SiO2(填化学式).
②清洗过程中,溶解的Fe2O3会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(3)步骤III中,加入Na2SO3的目的是将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
□Fe+□NO${\;}_{2}^{-}$+□H2O═□N2↑+□Fe3O4+□
②下面检测钝化效果的方法合理的是ab(填序号).
a.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
b.在炉面上滴加酸性KSCN溶液,观察红色消失的时间
c.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间.
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
II.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
III.向洗液中加入Na2SO3溶液;
IV.清洗达标,用NaNO2溶液钝化锅炉.
(1)在步骤I中:
①用NaOH是为了溶解除去水垢中的SiO2,反应的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
②已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(2)在步骤II中:
①加入稀盐酸和少量NaF溶液能除掉的水垢是CaCO3、Mg(OH)2、Fe2O3、SiO2(填化学式).
②清洗过程中,溶解的Fe2O3会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(3)步骤III中,加入Na2SO3的目的是将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
□Fe+□NO${\;}_{2}^{-}$+□H2O═□N2↑+□Fe3O4+□
②下面检测钝化效果的方法合理的是ab(填序号).
a.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
b.在炉面上滴加酸性KSCN溶液,观察红色消失的时间
c.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间.
16.下列反应的离子方程式正确的是( )
| A. | 用小苏打治疗胃酸(主要成分为盐酸)过多:HCO3-+H+=CO2↑+H2O | |
| B. | 氢氧化钡溶液和硫酸溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 澄清的石灰水跟稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
3.下列说法正确的是( )
| A. | 在化学反应中,原子重新组合时伴随着能量的变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
1.将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由小到大的顺序为 ( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | B. | c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c(H+). | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
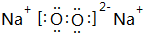 ;
;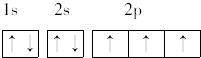 ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.