题目内容
1.用激光柱照射下列分散系时,不能产生丁达尔效应的是( )| A. | 石灰水 | B. | 稀豆浆 | C. | 云 | D. | Fe(OH)3胶体 |
分析 丁达尔效应是指:当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路.丁达尔现象是胶体特有的性质.
解答 解:A.石灰水是溶液,分散质微粒直径小于1nm是溶液,没有丁达尔效应,故A正确;
B.稀豆浆分散质微粒直径在1-100nm之间,是胶体,有丁达尔效应,故B错误;
C.Fe(OH)3胶体分散质微粒直径在1-100nm之间,是胶体,有丁达尔效应,故C错误;
D.云是胶体,有丁达尔效应,故D错误.
故选A.
点评 本题考查了胶体的性质应用,注意丁达尔效应是胶体特有的性质是解答本题的关键,题目较简单.

练习册系列答案
相关题目
11.在C(s)+CO2(g)?2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强
②增加碳的量
③恒容通入CO2
④恒容下充入N2
⑤恒容通入CO.
①增大压强
②增加碳的量
③恒容通入CO2
④恒容下充入N2
⑤恒容通入CO.
| A. | ①③④ | B. | ③④⑤ | C. | ①③⑤ | D. | ②③⑤ |
12.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
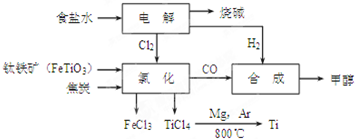
请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为$\frac{cVM}{10w}$%.(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
9.下列说法正确的是( )
| A. | 18 g H2O在标准状况下的体积是22.4 L | |
| B. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| C. | 在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3 | |
| D. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L |
16.关于能源,下列说法错误的是( )
| A. | 能源的开发和利用情况,可以衡量一个国家或地区的科学技术水平 | |
| B. | 目前新能源主要有:煤、石油、天然气、太阳能、氢能、风能等 | |
| C. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| D. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 |
6.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
| A. | 沉淀中OH-的质量为(n-m)g | |
| B. | 恰好溶解后溶液中的NO$\frac{-}{3}$的物质的量为aVmol | |
| C. | 反应过程中转移的电子的物质的量为$\frac{n-m}{17}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{aV}{1000}$)mol |
10.对Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
11.下列对“物质的量”的叙述正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量不是国际单位制的七个基本物理量之一 | |
| C. | 物质的量是摩尔的单位 | |
| D. | 阿伏加德罗常数的数值约为6.02×1023 |
 ;
;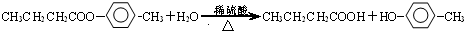 ;
;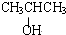 ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+