题目内容
16.下列反应的离子方程式正确的是( )| A. | 用小苏打治疗胃酸(主要成分为盐酸)过多:HCO3-+H+=CO2↑+H2O | |
| B. | 氢氧化钡溶液和硫酸溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 澄清的石灰水跟稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
分析 A.反应生成氯化钠、水、二氧化碳;
B.漏写生成水的离子反应;
C.反应生成氯化钙和水;
D.反应生成碳酸钙和水.
解答 解:A.用小苏打治疗胃酸(主要成分为盐酸)过多的离子反应为HCO3-+H+=CO2↑+H2O,故A正确;
B.氢氧化钡溶液和硫酸溶液反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.澄清的石灰水跟稀盐酸反应的离子反应为H++OH-═H2O,故C错误;
D.往澄清石灰水中通入少量二氧化碳气体的离子反应为Ca2++CO2+2OH-=CaCO3↓+H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
| A. | 沉淀中OH-的质量为(n-m)g | |
| B. | 恰好溶解后溶液中的NO$\frac{-}{3}$的物质的量为aVmol | |
| C. | 反应过程中转移的电子的物质的量为$\frac{n-m}{17}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{aV}{1000}$)mol |
7.下列物质的制备方法正确的是( )
| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
4.下列有关化学实验的叙述正确的是( )
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |
11.下列对“物质的量”的叙述正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量不是国际单位制的七个基本物理量之一 | |
| C. | 物质的量是摩尔的单位 | |
| D. | 阿伏加德罗常数的数值约为6.02×1023 |
8.已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
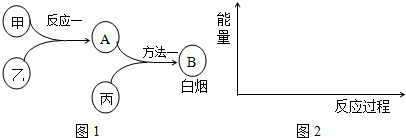
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
(2)已知反应一是放热反应,画出能量关系示意图2.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
5.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-98.32kJ/mol,下列表述正确的是( )
| A. | 在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量等于196.64kJ | |
| B. | 在容器中当有2mol SO2和1mol O2发生反应时,放出的热量等于196.64kJ | |
| C. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为-393.28kJ/mol | |
| D. | 在容器中当有4mol SO2和2mol O2发生反应时,反应SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)的反应热为98.32kJ/mol |