��Ŀ����
6�� ҹĻ���٣��������˻����᳡�����ڵƻ�Իͣ���ɪ�������貵��̻��ڿ�����ɰ����廷��ͼ�����볡�ڱ������Ӧ����ҹ�����������������ɣ��������������Դ�ͳ�Ļ�Ԫ�ء��й��족Ϊ��ɫ����ͼ1�DZ������Է��̻�����廷ͼ�����ش��������⣺
ҹĻ���٣��������˻����᳡�����ڵƻ�Իͣ���ɪ�������貵��̻��ڿ�����ɰ����廷��ͼ�����볡�ڱ������Ӧ����ҹ�����������������ɣ��������������Դ�ͳ�Ļ�Ԫ�ء��й��족Ϊ��ɫ����ͼ1�DZ������Է��̻�����廷ͼ�����ش��������⣺��1�����������˲��ֽ�����Ԫ����������ɫ��Ӧ���÷�Ӧ�������������������ѧ���仯����
��2��������һ�ֻ���������ǵ�ŨH2SO4����ȥ�������������ʱ��������������Ķ������������ҷ���ֻ����Ԫ�صĻ��ϼ۷����仯����д���÷�Ӧ�ķ���ʽ3KClO3+2H2SO4��Ũ��=2KHSO4+KClO4+H2O+2ClO2��
��3����ͼ2��ʾ����Ԫ������A��B��C��D��E���ֻ����ԲȦ���沿��ָ���ֻ����ﺬ��һ����ͬԪ�أ����ֻ����������ֶ�����Ԫ���γɣ�ÿ�ֻ������������Ԫ�أ�A����������Ҫ�ɷ֣�B��E������������������Ϊ18��B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ���������E�ķ��ӽṹģ��Ϊ
 ��C��D��Ϊԭ�Ӿ��壬C�봿���ڸ����µķ�Ӧ�ǹ�ҵ�Ʋ�������Ҫ��Ӧ֮һ��D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����������֮��Ϊ3��2������������Ϣ�ش��������⣺
��C��D��Ϊԭ�Ӿ��壬C�봿���ڸ����µķ�Ӧ�ǹ�ҵ�Ʋ�������Ҫ��Ӧ֮һ��D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����������֮��Ϊ3��2������������Ϣ�ش��������⣺��B��ˮ��Һ�������ԣ�����Ҫ�ĵ��뷽��ʽ�ɱ�ʾΪH2O2?HO2-+H+��D�Ļ�ѧʽ��Si3N4��
��A��B��E�о����е�һ��Ԫ�ط���ΪH��
��C�봿�Ӧ�Ļ�ѧ����ʽΪSiO2+Na2CO3$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����
��Һ̬B��Һ̬E��Ӧ������һ�ֵ��ʺ�һ�ֳ���Һ�壬1molB�μӷ�Ӧ�ų�����QkJ���䷴Ӧ���Ȼ�ѧ����ʽΪN2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=-2Q kJ/mol��
���� ��1���̻��������뵽���ֽ�����Ԫ�ص���ɫ��Ӧ�����������ӵļ����������ģ��������仯��
��2������Ϣ֪��ֻ����Ԫ�صĻ��ϼ۷����仯��KClO3�����绯��ӦΪKClO4��ClO2������KHSO4���ɣ�
��3��A����������Ҫ�ɷ֣�Ϊ���飻B����������������Ϊ18��B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ�����������֪BΪH2O2��B��C�ཻ�IJ���ΪOԪ�أ�C�봿���ڸ����µķ�Ӧ�ǹ�ҵ�Ʋ�������Ҫ��Ӧ֮һ����CΪSiO2��E����������������Ϊ18��E��������ԭ�ӹ��ɵķ��ӣ�ԭ��ƽ��������Ϊ3����E�к���HԪ�أ�EΪN2H4��D�к���SiԪ�أ�������HԪ�ػ�NԪ�أ���D������������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4����DΪSi3N4��
��� �⣺��1���̻��������뵽���ֽ�����Ԫ�ص���ɫ��Ӧ�����������ӵļ����������ģ��������仯��
�ʴ�Ϊ����ɫ��������
��2������Ϣ֪��ֻ����Ԫ�صĻ��ϼ۷����仯��KClO3�����绯��ӦΪKClO4��ClO2������KHSO4���ɣ���Ӧ����ʽΪ��3KClO3+2H2SO4��Ũ��=2KHSO4+KClO4+H2O+2ClO2����
�ʴ�Ϊ��3KClO3+2H2SO4��Ũ��=2KHSO4+KClO4+H2O+2ClO2����
��3��A����������Ҫ�ɷ֣�Ϊ���飻B����������������Ϊ18��B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ�����������֪BΪH2O2��B��C�ཻ�IJ���ΪOԪ�أ�C�봿���ڸ����µķ�Ӧ�ǹ�ҵ�Ʋ�������Ҫ��Ӧ֮һ����CΪSiO2��E����������������Ϊ18��E��������ԭ�ӹ��ɵķ��ӣ�ԭ��ƽ��������Ϊ3����E�к���HԪ�أ�EΪN2H4��D�к���SiԪ�أ�������HԪ�ػ�NԪ�أ���D������������Ԫ�ص�ԭ�Ӹ���֮��Ϊ3��4����DΪSi3N4��
��BΪH2O2��ˮ��Һ�������ԣ�����Ҫ�ĵ��뷽��ʽ�ɱ�ʾΪ��H2O2?HO2-+H+��DΪSi3N4��
�ʴ�Ϊ��H2O2?HO2-+H+��Si3N4��
��A��B��E�о����е�һ��Ԫ��ΪHԪ�أ��ʴ�Ϊ��H����
��C�봿�Ӧ�Ļ�ѧ����ʽΪ��SiO2+Na2CO3$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����
�ʴ�Ϊ��SiO2+Na2CO3$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����
��Һ̬BΪH2O2��Һ̬EΪN2H4�����߷�Ӧ������һ����̬���ʺ�һ�ֳ���Һ�壬���ɵ�����Ϊ������Һ��Ϊˮ��1molB�μӷ�Ӧ�ų�����QkJ����Ӧ�Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=-2Q kJ/mol��
�ʴ�Ϊ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��l����H=-2Q kJ/mol��
���� ���⿼��������ƶϡ���ɫ��Ӧ����ѧ����ʽ��д�ȣ��ѶȽϴ����ճ���18�����������ƶϵĹؼ�����Ҫѧ���Գ������ʵĽṹ�������������գ�

 2014��10�£��������������ȶ���������г���������������������ѧУ����ͣ�Σ���������ġ������֮һ������β������������β��������Ҫ����Ԫ��������������Ҫ��Ⱦ�CO��NOx��̼�⻯������Է������Ӧ��������壬���ٻ�����Ⱦ���䷴Ӧԭ��֮һ��2NO��g��+2CO��g���TN2��g��+2CO��g����H���ش��������⣺
2014��10�£��������������ȶ���������г���������������������ѧУ����ͣ�Σ���������ġ������֮һ������β������������β��������Ҫ����Ԫ��������������Ҫ��Ⱦ�CO��NOx��̼�⻯������Է������Ӧ��������壬���ٻ�����Ⱦ���䷴Ӧԭ��֮һ��2NO��g��+2CO��g���TN2��g��+2CO��g����H���ش��������⣺��1������֪���з�Ӧ��
��N2��g��+O2��g���T2NO��g����H1=+180.8kJ/mol
��2C��s��+O2��g���T2CO��g����H2=-221.2kJ/mol
��C��s��+O2��g���TCO2��g����H3=-393.6kJ/mol
���H���H1����H2����H3֮��Ĺ�ϵ�ǣ���H=2��H3-��H2-��H1����Ӧ2NO��g��+2CO��g���TN2��g��+2CO2��g�����ڷ��ȷ�Ӧ��������ȡ����ȡ���
��2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ�ij�о���ѧϰС���ڼ�����Ա��ָ���£��ռ�һ����������β����������ת�����Ӧ������ij�¶��£������崫������ò�ͬʱ���NO��COŨ�Ȳ������ݼ�¼���£�
| ʱ��/s | 0 | 2 | 3 | 4 |
| C��NO0����10-4mol•L-1�� | 20.0 | 3.00 | 2.00 | 2.00 |
| C��CO������10-3mol•L-1�� | 2.70 |
��3����С�黹�о�������ȡ����ݵ��ܱ�������ͨ��CO��NOʹ����һ�������·�����Ӧ���������Ӧ����������ͼ��ʾ��t1=��t2����
��NO��ת������a��b�κ�b��c�ε�ת���ʹ�ϵΪ����a-b����b-c�����������������=������
��a��b��c��d�ĸ��㣬�ĸ����ʾ��ѧ��Ӧ�ﵽƽ��״̬d��
�۽���c��ǰ�����ʱ仯��ԭ������һ�����ȷ�Ӧ��һ��ʼ��Ӧ�ų�����ʹ��ϵ���¶����ߣ���ʱ�¶���Ӱ�췴Ӧ���ʵ���Ҫ���أ����¶ȵ����ߣ���Ӧ���ʼӿ죬����һ��ʼʱ��Ӧ����������c����淴Ӧ�Ľ��з�Ӧ���Ũ�ȼ��٣���Ӧ��Ũ�ȵı仯��Ӱ�컯ѧ��Ӧ���ʵ���Ҫ���أ�����c���Ӧ���ʼ��٣���
| A�� | ������ĵ���ʽ | |
| B�� | ���������е���AgNO3��Һ�������е���Ԫ�أ�Br-+Ag+�TAgBr�� | |
| C�� | ��������KOH��Һ��Ӧ��CH3CH2Br+H2O$��_{��}^{KOH}$C2H5OH+KBr | |
| D�� | ����������ȡ�Ҷ����������¼�������ȥ���ӳɡ�ˮ�� |
| A�� | CH2=CH-CH2-CH3�� | B�� |  �� �� | ||
| C�� | ������ɶ�Ϊ CnH2nO2 ������ | D�� | CH3CH2Cl��CH3CH2CH2Cl |
| A�� | HSO3-����Һ�з���ˮ�⣺HSO3-+H2O?SO32-+H3O+ | |
| B�� | ��NaClO��Һ��ͨ������SO2��2ClO��+SO2+H2O�TSO32��+2HClO | |
| C�� | ��������Һ�Լ��ԣ�C6H5O-+H2O?C6H5OH+OH- | |
| D�� | ���Ե缫���MgCl2��Һ��Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$ OH-+Cl2��+H2�� |
| A�� | ʯ��ˮ | B�� | CO | C�� | ���� | D�� | C2H5OH |
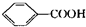 ��Ӧ��
��Ӧ�� $��_{��}^{HIO_{4}}$RCHO+R��CHO
$��_{��}^{HIO_{4}}$RCHO+R��CHO
 ��CCH3CHO��F
��CCH3CHO��F ��
�� +
+ $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +2H2O��
+2H2O��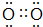 ��
�� ��
��