题目内容
18.下列反应的离子方程式正确的是( )| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O═SO32ˉ+2HClO | |
| C. | 苯酚钠溶液显碱性:C6H5O-+H2O?C6H5OH+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ OH-+Cl2↑+H2↑ |
分析 A.HSO3-在溶液中发生水解生成亚硫酸与氢氧根离子;
B.次氯酸根离子具有强的氧化性能氧化亚硫酸根离子;
C.苯酚钠为强碱弱酸盐,水解显碱性;
D.惰性电极电解MgCl2溶液生成氢氧化镁、氯气和氢气.
解答 解:A.HSO3-在溶液中发生水解,离子方程式:HSO3-+H2O?H2SO3+OH-,故A错误;
B.向NaClO溶液中通入少量SO2,离子方程式:SO2+H2O+3ClO-=SO42-+Cl-+2HClO,故B错误;
C.苯酚钠溶液水解生成苯酚与氢氧化钠,离子方程式:C6H5O-+H2O?C6H5OH+OH-,故C正确;
D.惰性电极电解MgCl2溶液,离子方程式:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Mg(OH)2↓+Cl2↑+H2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意盐类水解与电离的区别,题目难度不大.

练习册系列答案
相关题目
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题: ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: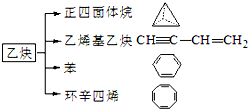 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: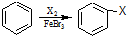 ).
). .
.

 的分子式为:C8H18,其一氯代物有4种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:(CH3)3CC(CH3)3
的分子式为:C8H18,其一氯代物有4种,该烃有多种同分异构体,其中有一种一氯取代物只有一种,写出这种同分异构体的结构简式:(CH3)3CC(CH3)3 .
. ,它属于高分子材料,大量使用塑料容易造成的环境问题是白色污染;
,它属于高分子材料,大量使用塑料容易造成的环境问题是白色污染; ;
;