题目内容
1.A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和.(1)B位于第2周期VA族,C常见单质的电子式
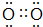 .
.(2)B、C、D、E元素的简单离子半径由小到大的顺序为Na+<O2-<N3-<S2-(用离子符号表示).
(3)C的一种氢化物分子中含有18电子,其结构式为H-O-O-H.
(4)已知A、E两种元素形成的化合物H,H结构与干冰相似,属于共价(填“离子”或“共价”)化合物.7.6g的H中含有的共用电子对数目为0.4NA.
(5)E的最高价氧化物对应的水化物的浓溶液和A的单质加热反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子,为第IVA族元素;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体F,则C是O元素、D是Na元素,F为Na2O2;A原子序数小于C,则A是C元素,B原子序数大于A而小于C,则B是N元素;
E的L层电子数等于K、M层电子数之和,则M层为6个电子,为S元素,再结合元素周期表结构、物质结构及性质分析解答.
解答 解:A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子,为第IVA族元素;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体F,则C是O元素、D是Na元素,F为Na2O2;A原子序数小于C,则A是C元素,B原子序数大于A而小于C,则B是N元素;
E的L层电子数等于K、M层电子数之和,则M层为6个电子,为S元素,
(1)B为N元素,N原子核外有2个电子层、最外层电子数是5,所以B位于第二周期VA族,C常见单质的电子式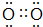 ,
,
故答案为:二;VA;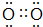 ;
;
(2)电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以B、C、D、E元素的简单离子半径由小到大的顺序为Na+<O2-<N3-<S2-,
故答案为:Na+<O2-<N3-<S2-;
(3)C是O元素,C的一种氢化物分子中含有18电子,为双氧水,其结构式为H-O-O-H,故答案为:H-O-O-H;
(4)已知C、S两种元素形成的化合物C,为CS2,H结构与干冰相似,属于共价化合物;每个二硫化碳分子中含有共用电子对4个,7.6g的H的物质的量为0.1mol,则7.6gH中含有的共用电子对数目为0.4NA,
故答案为:0.4NA;
(5)E的最高价氧化物对应的水化物的浓溶液是浓硫酸,加热条件下,C和浓硫酸反应生成二氧化碳、二氧化硫和水,方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查位置结构性质的相互关系及应用,涉及氧化还原反应、物质结构、元素周期律等知识点,正确判断元素是解本题关键,知道常见10电子、18电子分子,注意利用知识迁移法解答(4)题,题目难度不大.

| A. | 上述四种元素的原子半径大小为W<X<Y | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | 由W和Y元素组成的化合物不止一种 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| A. | 二氧化硫和二氧化碳都能使澄清的石灰水变浑浊 | |
| B. | 二氧化硫通入BaCl2溶液中生成BaSO3白色沉淀 | |
| C. | 二氧化硫通入滴有酚酞的NaOH溶液中,红色褪去,说明二氧化硫具有漂白性 | |
| D. | 硫在过量的氧气中燃烧生成三氧化硫 |

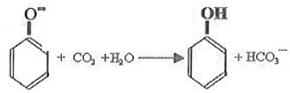

 ;
; .
. 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.如图1是北京鸟巢试放烟火奥运五环图,并回答下列问题: ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: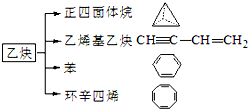 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: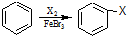 ).
). .
.
