题目内容
11.设在某温度时,在容积为1L的密闭容器内,把氮气和氢气两种气体混合,反应后生成氨气.实验测得,当达到平衡时,氮气和氢气的浓度各为2mol/L,生成氨气的浓度为3mol/L,试求:(1)这个反应在该温度下的平衡常数.
(2)氮气、氢气在反应开始时的浓度.
分析 (1)根据平衡常数表达式k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$计算;
(2)根据氨气平衡浓度计算氮气、氢气的浓度变化量,起始浓度=平衡浓度+浓度变化量,据此计算;
解答 解:(1)当达到平衡时,氮气和氢气的浓度各为2mol/L,生成氨气的浓度为3mol/L,所以根据平衡常数表达式k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$=$\frac{3{\;}^{2}}{2×2{\;}^{3}}$=$\frac{9}{16}$,答:这个反应在该温度下的平衡常数为$\frac{9}{16}$;
(2)根据根据N2+3H2?2NH3,
开始 3.5 6.5 0
转化 1.5 4.5 3
平衡 2 2 3
故氮气、氢气在反应开始时的浓度分别为3.5mol/L和6.5mol/L,
答:氮气、氢气在反应开始时的浓度分别为3.5mol/L和6.5mol/L.
点评 本题考查化学平衡的有关计算,根据平衡常数计算氨气的平衡浓度是解题关键,注意掌握平衡常数的用途.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
1.利用含铜、铁的粗锌制备硫酸锌及相关物质.工艺流程图及有关数据如下:
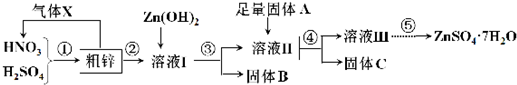
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.

| 物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
| Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-16 | 1.2×10-23 | 8.5×10-45 |
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为3Cu+2HNO3(稀)+3H2SO4=3CuSO4+2NO↑+4H2O,图中处理气体X要能够体现绿色化学思想,还需补充气体O2(填化学式).
(2)若溶液I中c(Cu2+)为0.05mol•L-1,则溶液Ⅱ中c(Fe3+)>4.0×10-11mol•L-1.
(3)若固体A是Zn,取9.61g固体C溶解于足量的500mL2mol•L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2mol•L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为14.71g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(4)溶液Ⅲ经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液Ⅲ还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是Zn(OH)2(填化学式).
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH${\;}_{4}^{+}$+Zn=2NH3+H2↑+Zn2+,造成电量自动减少.写出铅蓄电池不使用时,其正极上发生自放电的化学方程式.2PbO2+2H2SO4=2PbSO4+2H2O+O2↑.
2.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
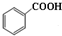 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O
相关物质的部分物理性质如上表格:
实验流程如下:

(1)制备苯甲酸乙酯,下列装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.
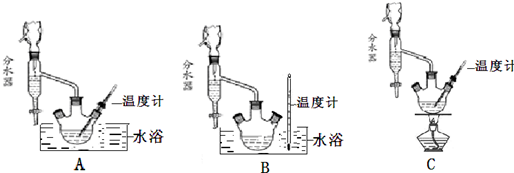
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).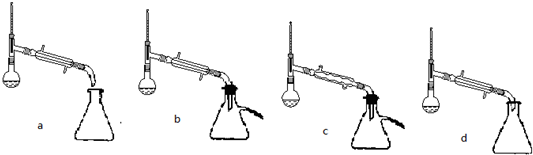
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
(一)制备苯甲酸乙酯
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如上表格:
| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |

(1)制备苯甲酸乙酯,下列装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
19.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 向小苏打溶液中加入过量的澄清石灰水:CO32-+Ca2+═CaCO3↓ | |
| D. | 向FeCl3溶液中加入Na:3Na+Fe3+═Fe+3Na+ |
6.从松树中分离得到的松柏醇,其结构简式为: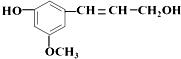 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
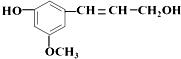 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
16.下列有关说法中,正确的是( )
| A. | 盐酸、漂白粉都是混合物 | B. | 127I和131I互为同素异形体 | ||
| C. | 硫酸铜、二氧化硫都是电解质 | D. | 分馏、干馏都是物理变化 |
3.在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL.则4个容器中气体的质量由大到小的顺序是( )
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
20.20gA物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD物质和0.2molE物质,则E物质的摩尔质量为( )
| A. | 100 g•mol-1 | B. | 108 g•mol-1 | C. | 55 g•mol-1 | D. | 96 g•mol-1 |
1.pH=1酸溶液和pH=13碱溶液等体积混合后pH正确的是( )
| A. | 混合溶液的pH值应等于7 | |
| B. | 如果酸是强酸,则pH一定小于7 | |
| C. | 如果碱是强碱,则pH一定不大于7 | |
| D. | 如果混合液的pH大于7,则碱一定为强碱 |