题目内容
焦亚硫酸钠(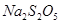 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: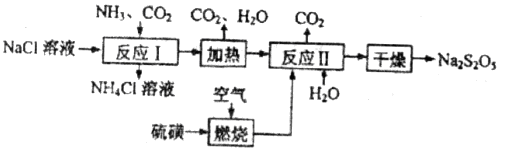
已知:反应Ⅱ包含 等多步反应。
等多步反应。
(1)反应Ⅰ的化学方程式为____________,反应Ⅰ进行时应先通入__________气体。
(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是__________。在上述工艺流程中可循环使用的物质是_____________。
(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近____________,若气体量不足,则会导致_______________。
(4)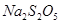 与稀硫酸反应放出
与稀硫酸反应放出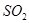 ,其离子方程式为___________。
,其离子方程式为___________。
(1)CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,NH3(1分)
(2)增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率,CO2和H2O
(3)2:1(1分),Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。
(4)S2O52—+2H+=2SO2↑+H2O。
解析试题分析:(1)本题考查侯德榜制碱法的原理,利用碳酸氢钠的溶解度较小,反应方程式为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,二氧化碳在水中的溶解度不大,氨气极易溶于水,为提高溶液中碳酸氢根的浓度,应先通入氨气;(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;由流程图知,可循环利用的物质是CO2和H2O;(3)反应Ⅱ中涉及的反应为Na2CO3+2SO2+H2O=2NaHSO3,2NaHSO3 Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。
Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。
考点:考查化学工艺流程及化学方程式书写。

 名校课堂系列答案
名校课堂系列答案据科学家预测:再过100年后,全球气温估计将上升大约1.4~5.8 ℃。根据这一预测,全球气温上升将给全球环境带来不可估测的影响,其中水资源的匮乏将是首当其冲。海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
(1)就目前技术而言,结合能源消耗等问题,下列适用于“海水淡化”的技术是 (填序号)。
| A.蒸馏法; | B.电渗析法; | C.冷结法; | D.离子交换法;E.反渗透法 |
(3)海水晒盐得到的母液中,还有大量的镁、钾离子和一定量的溴、碘化合物。其中通过先进的分离技术得到MgCl2·6H2O产品,此产品还需要在不断通入“干燥氯化氢”的条件下脱水才能得到无水MgCl2,原因是 ;
如果实验以海水、氯气等为基本原料来制得单质溴、碘,最基本的操作过程是 、 、 。
(4)钛被称为21世纪金属,具有密度小、强度大,不溶于一般的强酸、强碱等优良性能,广泛用于航空、航天以及生物医学等领域。工业上可以用Mg高温还原TiCl4而制得。请设计合理的实验操作,处理上述反应产物,得到纯钛,简述操作过程: 。
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如下:
回答下列问题:
(1)在废渣溶解操作时,为了加速废渣溶解的措施是:___________________、__________________(任写两点)
(2)物质A是一种氧化剂
①工业上最好选用 (填序号)
| A.空气 | B.Cl2 | C.MnO2 | D.H2O2, |
③写出A参与反应的离子方程式为__________________________________________
(3根据下图有关数据,你认为工业上氧化操作时应控制的条件是__________________。
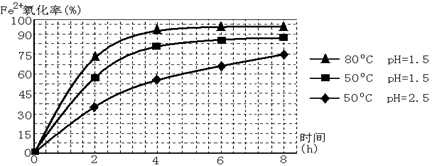
(4)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:_______________________________________________________。
(5)写出铵黄铁矾晶体溶于适量蒸馏水中,往其中加入过量Ba(OH)2溶液,发生反应的离子方程式为:_____________________________________________________
(6)回收所得的(NH4)2SO4晶体可能含有的杂质是:___________________________
工业上用白云石制备高纯氧化镁的工艺流程如下:
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是 。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 。
| A.蒸发皿 | B.坩埚 | C.泥三角 | D.石棉网 |

(3)从溶液中获得CaSO4·2H2O的操作是蒸发浓缩、 、过滤、洗涤、干燥。
(4)写出沉淀反应中的离子方程式: 。检验沉淀是否洗净的方法是: 。
(5)沉淀反应过程中,温度对产品的纯度也有一定的影响。如图为反应温度对氧化镁纯度的影响。最终确定本反应的适宜温度为 。

[化学-选修化学与技术](15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为 。加热煮沸的主要目的 是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 。过滤III需趁热过滤的理由是
化学工业在经济发展中的作用举足轻重。下列有关工业生产的叙述中,正确的是 ( )
| A.硫酸生产中常采用高压条件来提高SO2的转化率 |
| B.合成氨中采用及时分离液态氨来提高反应速率 |
| C.电解精炼铜中,溶液中c(Cu2+)基本保持不变 |
| D.氯碱工业中阳极得到氢氧化钠和氢气 |
