题目内容
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称) 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu (填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
I:3Si + 2N2 Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)
Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)
Ⅱ:(1)二氧化硅
(2)SiO2 + 2C Si + 2CO↑
Si + 2CO↑
(3)不能(1分),阳Cu -2e- =Cu2+ 阴2H+ +2e-=H2↑(除标注外,其余各2分)
解析试题分析:I.硅与纯氮气发生化合反应,制得Si3N4,但所得产品中混有硅,不容易分离,方法二中除Si3N4外,其余都为气体,产品纯度高;方法三根据质量守恒定律,可以推断气体成分。II.Y与X在光照或点燃条件下可反应,可推断为H2和Cl2,X、高纯硅、原料B的主要成分都可与Z反应,Z的焰色呈黄色.可推断Z是NaOH,X是Cl2,Y是H2, B是SiO2,A是NaCl,电解是若用Cu做阳极,铜的还原性强,失电子发生氧化反应,阴极H+得电子发生还原反应。
考点:考查物质的制备、元素化合物性质,电解原理

工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)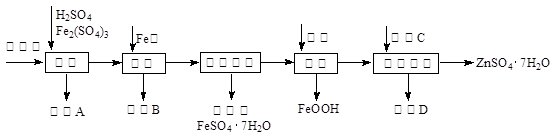
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
我国及美国、日本等国家都已研制出一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )。
| A.氧化铝陶瓷 | B.氮化硅陶瓷 |
| C.光导纤维 | D.玻璃钢 |
下列工业生产中,各物质的物质的量间的关系式不正确的是( )
| A.制漂白粉:2Cl2~Ca(ClO)2 |
| B.制H2SO4:FeS2~2H2SO4 |
| C.合成氨:C~H2~2/3NH3 |
| D.制HNO3:NH3~HNO3 |
下列化学肥料属于复合肥料的是 ( )
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
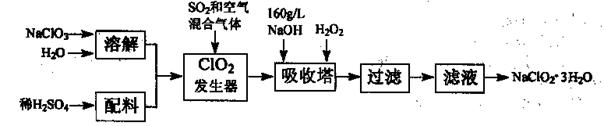
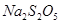 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: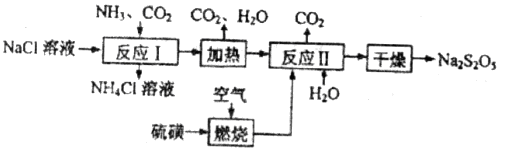
 等多步反应。
等多步反应。 ,其离子方程式为___________。
,其离子方程式为___________。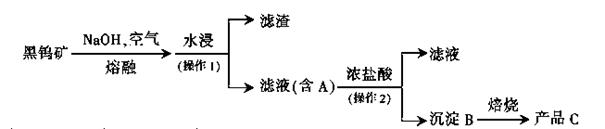


 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4