题目内容
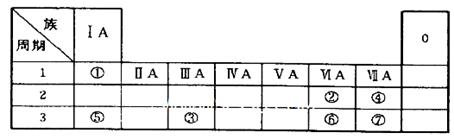
下列各组顺序的排列不正确的是( )
| A.原子半径:Na>Mg>Al>H | B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 | D.氧化性:K+<Na+<Mg2+<Al3+ |
B
试题分析:A.Na、Mg、Al是第三周期的元素,元素的原子序数越大,原子半径就越小。而H是第一周期的元素。元素的原子核外电子层数越多,原子半径就越大。所以原子半径:Na>Mg>Al>H。正确。B.元素的非金属性:Cl>S>P.亅的非金属性越强,其氢化物的稳定性就越强。因此热稳定性: HC l>H2S>PH3。错误。C.元素的非金属性:P>C>Si,元素的非金属性越强,其最高价的含氧酸的酸性就越强。所以酸性强弱:H2SiO3<H2CO3<H3PO4。正确。D.元素的金属性:K>Na>Mg>Al.元素的金属性越强,其离子与电子的结合力就越弱。即氧化性越弱。因此氧化性:K+<Na+<Mg2+<Al3+。正确。

练习册系列答案
相关题目