题目内容
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是( )
A.原子半径:Z>W>X
B.若Z的最高价氧化物与Y的气态氢化物溶液混合后有气体放出,则W的气态氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见的液态化合物,则W单质溶于水形成的溶液有漂白性
| | X | | Y |
| Z | | W | |
B.若Z的最高价氧化物与Y的气态氢化物溶液混合后有气体放出,则W的气态氢化物不稳定
C.若Y、W的质子数之和为23,则Z能形成碱性氧化物
D.若X能形成两种常见的液态化合物,则W单质溶于水形成的溶液有漂白性
C
试题分析:A、根据元素周期律中原子半径的比较,电子层数越多半径越大,核电荷数越多,半径越小,所以原子半径:Z>W>X,正确;B、由4种元素在周期表中的位置判断,非金属性最强的W也只能是S元素,而硫化氢不稳定,越向左移,W的非金属性越弱,其气态氢化物越不稳定,正确;C、设Y的原子序数是x,则W的原子序数是x+7,则x+x+7=23,解得x=8,Z是Al元素,不能形成碱性氧化物而能形成两性氧化物,错误;D、X能形成两种常见的液态化合物,则X是O元素,形成的水与过氧化氢都是液态化合物,W是Cl元素,其单质溶于水生成的次氯酸具有漂白性,正确,答案选C。

练习册系列答案
相关题目
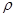 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含