题目内容
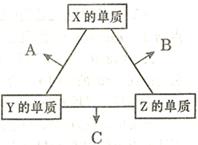
已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是
| A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C.若M属于离子化合物,则该化合物中只存在离子键 |
| D.若M属于离子化台物,则该化合物中原子个数比可能为1:2 |
D
试题分析:A、若X和Y处于同一周期,未指明X、Y的原子序数的大小关系,所以原子半径的大小无法判断,错误;B、若X和Y处于不同的周期,则M溶于水所得溶液有可能显中性,如氯化钙,错误;C、M是离子化合物如过氧化钠,该化合物中存在离子键、共价键,错误;D、M属于离子化台物,如CaCl2,原子个数比可能为1:2,正确,答案选D。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目