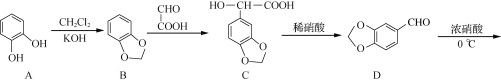
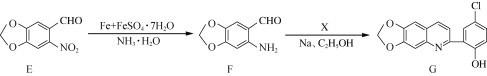
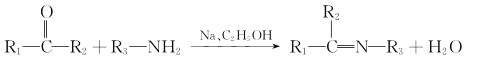题目内容
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
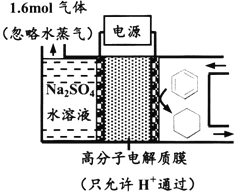
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
【答案】B
【解析】
A. 多孔电极可增大电极与电解质溶液接触面积,降低能量损失,故A正确;
B. 该过程苯被还原为环己烷,C-H键没有断裂,形成新的C-H键,故B错误;
C. 储氢是将苯转化为环己烷,电极反应式为C6H6+6e-+6H+===C6H12,故C正确;
D. 根据图示,苯加氢发生还原反应生成环己烷,装置中右侧电极为阳极,根据放电顺序,左侧电极反应式为2H2O-4e-=O2↑+4H+,生成1.6molO2失去的电子量为6.4mol,根据阴阳得失电子守恒,阴极得到电子总数为6.4mol,若η=75%,则生成苯消耗的电子数为6.4mol×75%=4.8mol,苯发生的反应C6H6+6e-+6H+===C6H12,参加反应的苯的物质的量为4.8mol/6=0.8mol,故D正确;
故选B。

【题目】氢能被视为最具发歸力的清洁能源,开发新型储氣材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如 下反应制得:3CH4+2 (HB=NH) 3+6H2O=3CO2+6H3BNH3
(1)基态B原子的价电子排布式为___________,B、C, N, O第一电离能由大到小的顺序为_________,CH4、H2O、CO2的键角按照由大到小的顺序排列为___________。
(2)与(HB=NH)3,互为等电子体的有机分子为___________(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研宄中心的Datta和Pati等人借助ADF软件对一种新 型环烯类储氢材料(C16S8)进行研宄,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
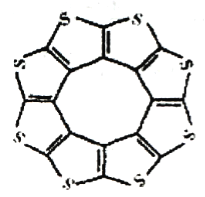
①C16S8分子中C原子和S原子的杂化轨道类型分别为___________。
②相关键长数据如表所示:
化学键 | C-S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能______________________。
③C16S8与H2微粒间的作用力是___________。
(2)有储氢功能的铜合金晶体具有立方最密堆积结构,晶胞中Cu原子位于面心,Ag 原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的四面体空隙中。该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为___________。

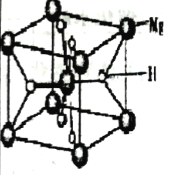
(3)MgH2是金属氢化物储氢材料,其晶胞如上图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
【题目】我国自主研发的“蓝鲸一号”在中国南海神狐海域完成可燃冰连续试采,并得到中共中央国务院公开致电祝贺。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是_______________________________(回答一条即可)。
(2)甲烷自热重整是一种先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+ | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158. 6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
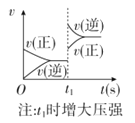
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
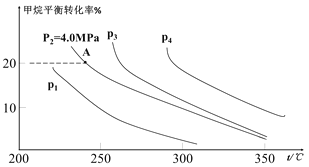
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和环境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
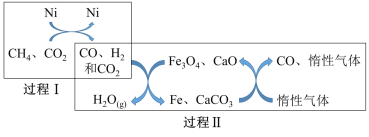
①过程II中第二步反应的化学方程式为_________。
②过程II的催化剂是______,只有过程I投料比![]() _______,催化剂组成才会保持不变。
_______,催化剂组成才会保持不变。