题目内容
下列说法正确的是:( )
则可以计算出反应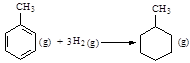 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 |
| B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
| D.已知: |
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/ kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应
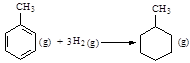 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1C
试题分析:A.气体转化为液体是放热过程,则正确的表达为:H2O(g)
 H2O(l)△H=-40.69kJ?mol-1,故A错误;B.含有固体MgCO3的溶液中,Mg2+离子和CO32-离子都能水解,水解后离子浓度不相等,并且在不同的温度下,溶度积常数不同,故B错误;C.因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故C错误;D.NH3?H2O溶液中加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故D正确。故选:D。
H2O(l)△H=-40.69kJ?mol-1,故A错误;B.含有固体MgCO3的溶液中,Mg2+离子和CO32-离子都能水解,水解后离子浓度不相等,并且在不同的温度下,溶度积常数不同,故B错误;C.因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故C错误;D.NH3?H2O溶液中加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故D正确。故选:D。
练习册系列答案
相关题目

 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是 SO2(g)+Q,Q值小于297.16 kJ
SO2(g)+Q,Q值小于297.16 kJ
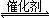 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H
 HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)