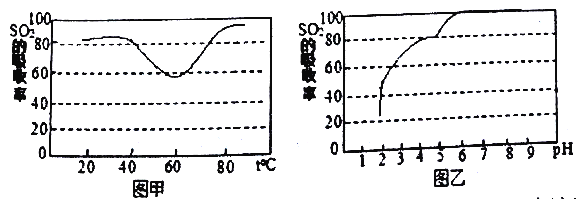
题目内容
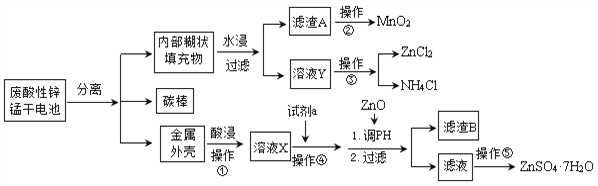
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,利用回收的某酸性锌锰干电池,处理可得到多种化工原料,并制备ZnSO4·7H2O。经查询该电池一种一次性电池,外壳为金属锌铁合金,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的填充物,放电过程产生MnOOH。
已知:Ksp(Zn(OH)2)=10-17;Ksp(Fe(OH)3)=10-39;![]()
![]() = 4.64 lg2 = 0.3
= 4.64 lg2 = 0.3
回答下列问题:
(1)操作①的酸浸选用的酸为__________(填化学式),溶液X含有的阳离子为_________。
(2)滤渣A进行操作②得到较纯的MnO2,最简便的方法为__________,其原理是________。
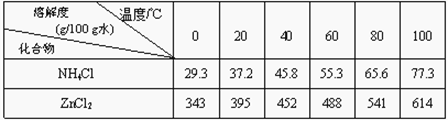
(3)操作③和操作⑤,可通过__________、过滤、洗涤、晾干等步骤,分离提纯得到产品。
(4)操作④选用的试剂a选用___________(填化学式),其目的是______________________________(用离子方程式表示),继续加 ZnO调节pH,生成氢氧化铁沉淀,铁刚好沉淀完全的pH约为________ (离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)。
【答案】 H2SO4 Zn2+、 Fe2+ 在足量的空气或氧气中加热 碳粉转变为CO2, MnOOH氧化为MnO2 加热浓缩、冷却结晶 H2O2 H2O2+2Fe2++2H+=2Fe3++2H2O 2.7
【解析】(1) 由于要生成硫酸锌,所以①操作用的酸为硫酸,与金属锌铁合金反应生成Zn2+、 Fe2+ ;
(2)滤渣A中主要为碳粉、MnOOH与MnO2,所以要出去C仅需要反应生成CO2气体, MnOOH可由加热反应生成MnO2除去,最直接方法为灼烧,所以反应条件为在足量的空气或氧气中加热;
(3)由于氯化铵、氯化锌、ZnSO4·7H2O的溶解度受温度影响较大,可采用结晶分离回收,即通过加热浓缩、冷却结晶等操作提纯;
(4)由于要生成3价铁,a应该具有氧化性,所以应采用H2O2,在酸性条件下反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O。根据氢氧化铁的溶度积可知,铁离子完全沉淀时,溶液中c(OH-)=![]() mol/L=4.64
mol/L=4.64![]() mol/L,所以pH=- lg4.64
mol/L,所以pH=- lg4.64![]() =2.7。
=2.7。