��Ŀ����
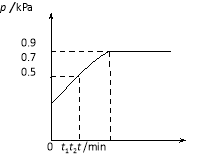
����Ŀ��һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN(g)bM(g)��M��N�����ʵ�����ʱ��ı仯��������ͼ��ʾ��

(1)�˷�Ӧ�Ļ�ѧ����ʽ����___________��
(2)t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ________________________��
(3)����������˵��������Ӧ�ﵽƽ��״̬����_________(����ĸ���)��
A.��Ӧ��M��N�����ʵ���֮��Ϊ1��1
B.������������������ʱ��ı仯���仯
C.�������������ʵ�������ʱ��ı仯���仯
D.��λʱ����ÿ����a mol N��ͬʱ����b mol M
E.��������ѹǿ����ʱ��ı仯���仯
���𰸡�(1)2 (2) ![]() mol��L��1��min��1 (3)CE
mol��L��1��min��1 (3)CE
��������
(1)��ѧ������֮�ȵ������ʵ����ı仯��֮�ȣ�����a��b��(8 mol��2 mol)��(5 mol��2 mol)��2��1���÷�Ӧ�Ļ�ѧ����ʽΪ2N(g)![]() M(g)��
M(g)��
(2)v(M)��![]() ��
��![]() mol��L��1��min��1��
mol��L��1��min��1��
(3)�ﵽƽ��״̬ʱ������ֵ�Ũ�Ȳ��ٷ����仯�����ʵ���֮�Ȳ��䣬����˵�����ʵ�����ȣ�Aѡ����÷�Ӧ�ķ�Ӧ��������ﶼ�����壬���������غ㶨�ɣ���Ӧǰ������������ʼ�ղ��䣬Bѡ����÷�ӦΪ���������С�ķ�Ӧ������Ӧû�дﵽƽ��״̬����Ӧ����������������ʵ�����ѹǿʼ���ڼ�С�����������ٷ����仯ʱ����˵����Ӧ�ﵽ��ƽ��״̬��C��Eѡ����ȷ������a mol N������b mol M����ʾ��������Ӧ���ʣ�û�������淴Ӧ���ʵĴ�С������˵����Ӧ�ﵽ��ƽ��״̬��Dѡ�����

����Ŀ������������18������������CH3OCH3����һ��Ӧ��ǰ�����������ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��
��� | �Ȼ�ѧ����ʽ | ��ѧƽ�ⳣ�� |
�� | CO��g��+2H2��g�� | K1 |
�� | 2CH3OH��g�� | K2 |
�� | CO��g��+H2O��g�� | K3 |
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C=O | H��O | C��H |
E/��kJ��mol��1�� | 436 | 343 | 1076 | 45 | 413 |
���������ݼ�����H1= ��
��2���ù��յ��ܷ�ӦΪ3CO��g��+3H2��g��![]() CH3OCH3��g��+CO2��g����H���÷�Ӧ��H= ����ѧƽ�ⳣ��K= ���ú�K1��K2��K3�Ĵ���ʽ��ʾ����
CH3OCH3��g��+CO2��g����H���÷�Ӧ��H= ����ѧƽ�ⳣ��K= ���ú�K1��K2��K3�Ĵ���ʽ��ʾ����
��3�����д�ʩ�У������CH3OCH3���ʵ��� ��
A������������� B�������¶�
C�����ø�Ч���� D������ѹǿ
��4�������з�Ӧ���ͷ�Ӧ���ֱ��ڲ�ͬ�ķ�Ӧ���н��У���Ӧ���������ù����з�Ӧ���ķ��������CH3OCH3�IJ��ʣ�ԭ���� ��
��5����n��H2��/n��CO��=2 ͨ��1L�ķ�Ӧ���У�һ�������·�����Ӧ��4H2��g��+2CO��g��![]() CH3OCH3��g��+H2O��g����H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ������˵����ȷ���� ��
CH3OCH3��g��+H2O��g����H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ������˵����ȷ���� ��
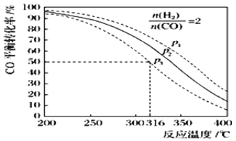
A���÷�Ӧ����H��0
B������p2��316��ʱ��Ӧ�ﵽƽ�⣬��CO��ת����С��50%
C������p3��316��ʱ��Ӧ�ﵽƽ�⣬H2��ת���ʵ���50%
D������p3��316��ʱ����ʼʱn��H2��/n��CO��=3�����ƽ��ʱCO��ת���ʴ���50%
E������p1��200��ʱ����Ӧ��ƽ����¶Ⱥ�ѹǿ���䣬�ٳ���2mol H2��1mol CO����ƽ��ʱ�����ѵ������������
��6��ij�¶��£���8.0mol H2��4.0mol CO�����ݻ�Ϊ2L���ܱ������У�������Ӧ��4H2��g��+2CO��g��CH3OCH3��g��+H2O��g������Ӧ��ƽ����ö����ѵ��������Ϊ25%������¶��·�Ӧ��ƽ�ⳣ��K= ��