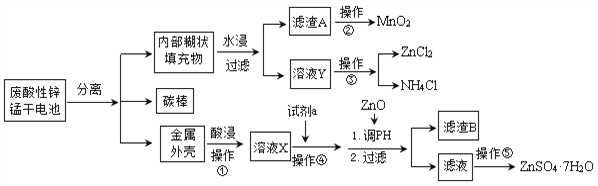
题目内容
【题目】I.丙烯和乙烯都是石油化工最重要的基础原料。主要工业生产途径如下:
途径①CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径②nCH3OH(g)![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9kJ/mol、2056.5 kJ/mol和285.8 kJ/mol,则△H1=_____ kJ/mol。
(2)途径①制备丙烯,要提高丙烯的产率最好采用______条件。(填“高压”或“低压”)
(3)途径②控制适当的条件(温度、压强、催化剂等)可以调节N[N=n(乙烯)/n(丙烯)]在0~1.5之间变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是__________。
②在体积为V的反应器中加入一定量的甲醇,反应1h后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
II:(4)含硫煤燃烧产生SO2,利用尿素[CO(NH2)2]水解的溶液可以吸收空气中的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)
①氨基甲酸铵会与空气中的SO2和O2反应生成(NH4)2SO4,该反应的化学方程式为________。
②-定条件下,用尿素水解液吸收空气中的SO2,测得SO2的吸收率随溶液的温度变化如图甲所示。温度高于60℃时,SO2的吸收率逐渐升高的原因是________。
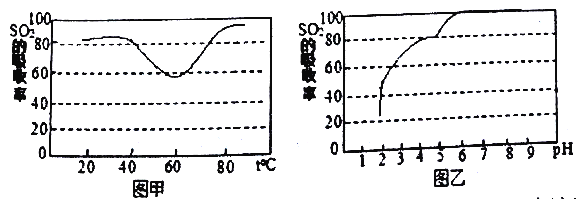
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图乙所示。尿素深液吸收空气中的SO2后,溶液的pH会降低,为提高SO2的吸收率和充分回收产物,最好向溶液中加入______(填溶液的名称)并控制pH为_______。
【答案】 +122.4 低压 使用高选择性催化剂 75% 2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑ 温度升高,尿素水解生成氨基甲酸铵更快 氨水 6
【解析】(1)对应的热化学方程式为:①C3H8(g)+5O2 (g)=3CO2(g)+4H2O(l) △H3=-2219.9 kJ·mol-1、②H2(g)+1/2O2(g)=H2O(l) △H4=-285.8 kJ·mol-1、③ C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H5=-2056.5 kJ·mol-1,①-②-③可得:CH3CH2CH3(g)=CH2=CHCH3(g)+H2(g) △H1=△H3-△H4-△H5,所以△H1=△H3-△H4-△H5=-2219.9 kJ·mol-1+285.8 kJ·mol-1+2056.5 kJ·mol-1= +122.4 kJ·mol-1。(2)CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率;(3)①有些催化剂具有化学选择性,只能催化某一个反应,使该反应成为最主要的反应,从而提高特定的产物在所有产物中的比例。②当生产的乙烯和丙烯的物质的量之比为1:1时,发生的反应的方程式为5CH3OH
CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率;(3)①有些催化剂具有化学选择性,只能催化某一个反应,使该反应成为最主要的反应,从而提高特定的产物在所有产物中的比例。②当生产的乙烯和丙烯的物质的量之比为1:1时,发生的反应的方程式为5CH3OH![]() C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
5CH3OH![]() C2H4+C3H6+5H2O △n
C2H4+C3H6+5H2O △n
5 1+1+5-5=2
x 0.64×106/32×30%=6×103
所以有=![]() ,解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。(4)①氨基甲酸铵会与空气中的SO2和氧气反应生成(NH4)2SO4,而H2NCOONH4被氧化为二氧化碳,则反应的化学方程式为:2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑。②尿素水解放热,常温下水解反应较慢,温度升高,尿素水解生成氨基甲酸铵的速率加快,使得SO2的吸收率升高。③根据图乙可知,溶液的pH>6时,SO2的吸收率较高,则需要控制在6左右,需要加入碱性物质调节溶液的PH,为了不引入新杂质,可以选用氨水进行调节。
,解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。(4)①氨基甲酸铵会与空气中的SO2和氧气反应生成(NH4)2SO4,而H2NCOONH4被氧化为二氧化碳,则反应的化学方程式为:2H2NCOONH4+2SO2+O2+2H2O=2(NH4)2SO4+2CO2↑。②尿素水解放热,常温下水解反应较慢,温度升高,尿素水解生成氨基甲酸铵的速率加快,使得SO2的吸收率升高。③根据图乙可知,溶液的pH>6时,SO2的吸收率较高,则需要控制在6左右,需要加入碱性物质调节溶液的PH,为了不引入新杂质,可以选用氨水进行调节。