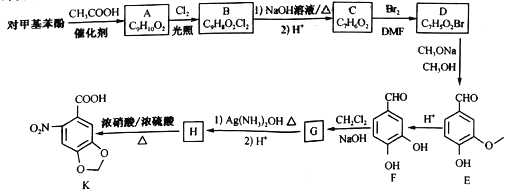
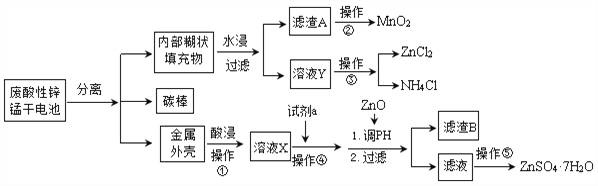
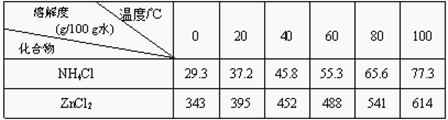
题目内容
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________(1分),中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3中除σ键外,还存在___________。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
【答案】 3d104s2 F>Zn>K 锌的原子半径较大,金属键较弱 V形 sp3 离子键和π键 6 ![]()
【解析】(1)基态锌原子核外电子由4层,其价电子分布为3d104s2;与元素周期表右上角距离顺序为K >Zn> F,所以电负性为:F>Zn>K;
(2). 锌的原子核外电子层数多,半径较大,使得其单质中金属键较弱;
(3)OF2存在两个孤对电子,则分子结构呈V型,其杂化类型与水一样为sp3不等性杂化;
(4)臭氧化钾中,3个O原子共同失去1个电子呈-1价,3个O原子间即有σ键也有π键,而K+与O3-采用离子键结合;
(5). ①由晶胞可知,每个Zn2+的周围有12个F-,而每个F-为2个Zn2+所共用,所以Zn2+的配位数为6;
②![]() g·cm-3。
g·cm-3。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目