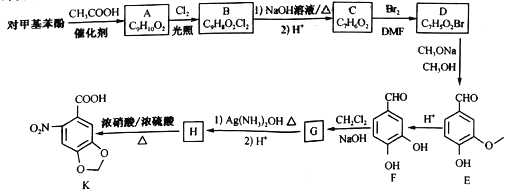
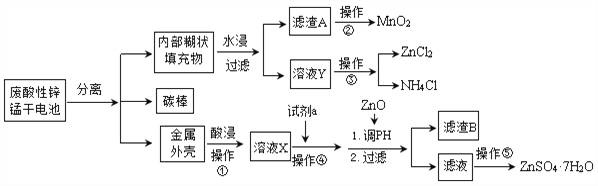
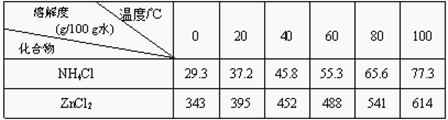
题目内容
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
【答案】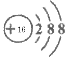
![]() 2NH3·H2O +Fe2+
2NH3·H2O +Fe2+![]() =2
=2![]() + Fe(OH)2↓
+ Fe(OH)2↓
【解析】
(1)根据硫离子的质子数和核外电子数写出离子的结构示意图;(2)根据氯气具有强氧化性、Fe2+具有还原性判断;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水.
(1)硫离子核内有16个质子,核外有18个电子,离子的结构示意图为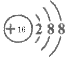 ;(2)氯气具有强氧化性、Fe2+化合价可升高,具有还原性,二者发生氧化还原反应生成Fe3+;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水,离子反应方程式为2NH3·H2O +Fe2+=2
;(2)氯气具有强氧化性、Fe2+化合价可升高,具有还原性,二者发生氧化还原反应生成Fe3+;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水,离子反应方程式为2NH3·H2O +Fe2+=2![]() + Fe(OH)2↓.
+ Fe(OH)2↓.

【题目】乙苯(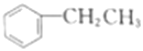 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
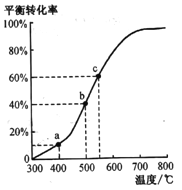
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。