题目内容
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
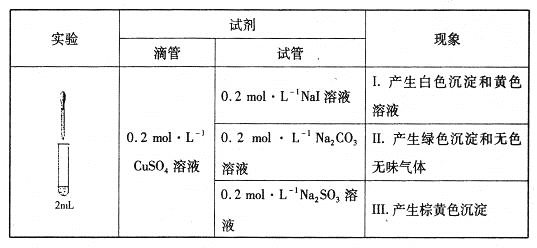
(1)经检验,现象I的白色沉淀为CuI,则反应的离子方程式为_____________________,氧化产物与还原产物的物质的量之比为____________。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式__________________________________________________;
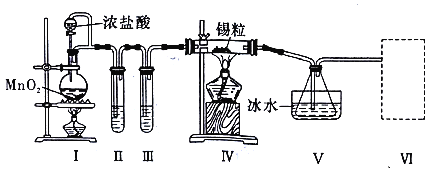
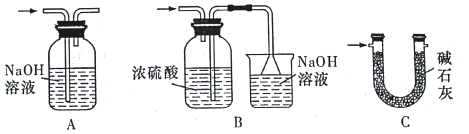
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→_______→g f→____→_____→_____→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是______________________________。
②通过下列实验证实,沉淀中含有Cu2+和SO32-
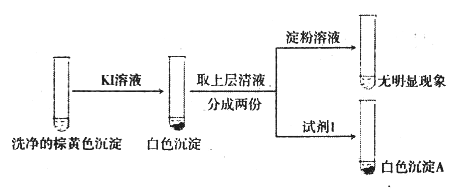
a.白色沉淀A是BaSO4,试剂1是_____________________。
b.证实沉淀中含有Cu+和SO32-的理由是___________________________。
【答案】2 Cu2++4I-= 2CuI↓+ I2 1:2 xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O kj de hi bc 有红色固体析出 盐酸和BaCl2溶液 在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-
(x+y) Cu+ xCO2+(x+2y+z) H2O kj de hi bc 有红色固体析出 盐酸和BaCl2溶液 在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-
【解析】
(1)经检验,现象I的白色沉淀为CuI,铜元素的化合价由+2价降低到-1价,则碘离子中碘元素化合价由-1价升高到0价,则反应的离子方程式为2 Cu2++4I-= 2CuI↓+ I2;该反应中氧化产物为碘单质,还原产物为CuI,所以氧化产物与还原产物的物质的量之比为1:2;综上所述,本题答案是:2 Cu2++4I-= 2CuI↓+ I2;1:2。
(2) ①xCuCO3·yCu(OH)2·zH2O与氢气反应生成单质铜、水、二氧化碳,反应方程式为:xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O;综上所述,本题答案是:xCuCO3·yCu(OH)2·zH2O+(x+y)H2
(x+y) Cu+ xCO2+(x+2y+z) H2O;综上所述,本题答案是:xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O。
(x+y) Cu+ xCO2+(x+2y+z) H2O。
②实验中要测定生成的水、二氧化碳的量,从a口出来气体中含有水蒸气和挥发出来的氯化氢气体,会对实验造成干扰,应先用水吸收氯化氢气体,再用浓硫酸吸收水蒸气;之后,与碱式碳酸铜发生反应,产生的两种气体先用浓硫酸吸收水蒸气,再用U型管中的碱石灰吸收二氧化碳,同时连上装有碱石灰的球形干燥管,避免空气中的水和二氧化碳进入U型管而产生误差,因此装置的连接顺序为:a→kj→gf→de→hi→bc→l;综上所述,本题答案是:kj ,de, hi, bc。
(3)①由已知可知Cu+和稀硫酸反应生成Cu和Cu2+,所以用稀硫酸证实沉淀中含有Cu+的实验操作和现象为取一定量的沉淀于试管中,向其中加入稀硫酸,有红色固体析出。综上所述,本题答案是:有红色固体析出。
②a.证明溶液中有SO42-,需要加入盐酸和BaCl2溶液,生成白色沉淀BaSO4,因此试剂1是HCl和BaCl2溶液;综上所述,本题答案是:盐酸和BaCl2溶液。
b.根据“已知”,加入KI溶液生成白色沉淀CuI,说明溶液中有Cu2+,向清液中加入淀粉溶液没有颜色变化,说明生成的I2被SO32-还原成I-,SO32-被氧化为SO42-,向清液中加入盐酸和BaCl2溶液,产生BaSO4沉淀;因此证实沉淀中含有Cu2+和SO32-的理由是在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-,溶液中存在Cu2+和SO32-;综上所述,本题答案是:在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。

【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________;(填编号)
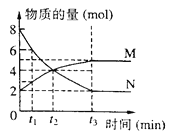
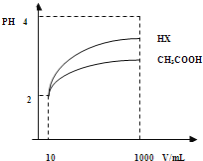
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________,稀释后,HX溶液中水电离出来的c(H+)_______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________.(填准确数值).