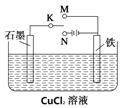
��Ŀ����
����Ŀ�������йصζ���˵����ȷ���ǣ� ��
A. ��25mL�ζ��ܽ����к͵ζ�ʱ����ȥ��Һ�����Ϊ21.7mL
B. �ñ���KOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ���Ʊ���Һ�Ĺ���KOH����NaOH���ʣ�����ƫ��
C. ��C1mol/L���Ը��������Һ�ζ�V2mLδ֪Ũ�ȵ�H2C2O4��Һ�����ζ��յ���ȥ���Ը��������Һ���ΪV1mL����H2C2O4��Һ��Ũ��Ϊ![]() mol/L
mol/L
D. ��δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ��ᵼ�²ⶨ���ƫ��
���𰸡�B
��������A���ζ��ܵľ���Ϊ0.01ml����A����B�������Ʊ���Һ�Ĺ���KOH����NaOH���ʣ�ʹKOHŨ��ƫ�ߣ��ζ�δ֪Ũ�ȵ�����ʱ����ʹ���ı�Һ�����ƫС��ʹ��������Ũ��ƫС��C�����Ը��������Һ�ζ�δ֪Ũ�ȵ�H2C2O4��Һ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O n��KMnO4����n��H2C2O4��=2��5����H2C2O4��Һ��Ũ��Ϊ![]() ,��C����D����δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ�ʹ��õ�������Һ���ƫС�����²ⶨ���ƫ�ͣ���D����ѡB��
,��C����D����δ֪Ũ�ȵ�����ζ���֪Ũ�ȵ�NaOH��Һʱ������ȡ����ʱ���ζ�ǰ���ӣ��ζ����յ���ӣ�ʹ��õ�������Һ���ƫС�����²ⶨ���ƫ�ͣ���D����ѡB��

 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�����Ŀ��25��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1�����ʵ���Ũ��Ϊ0.1mol/L�������������ʣ�a��Na2CO3��b��NaClO��c��CH3COONa d��NaHCO3��pH�ɴ�С��˳���ǣ�________________�������ţ�
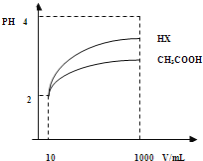
��2�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��_____________������ڡ��������ڡ���С�ڡ��������ƽ�ⳣ����������_________________��ϡ�ͺ�HX��Һ��ˮ���������c��H+��_______������Һˮ�������c��H+��������ڡ��������ڡ���С�ڡ��������ǣ�_______________________��
��3��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO������c��Na+��=____________________������ȷ��ֵ����
����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ(���ֲ�������ȥ)����W��X��������( )

ѡ�� | W | X |
A | ϡ���� | NaAlO2��Һ |
B | ϡ���� | Fe |
C | CO2 | Ca(OH)2��Һ |
D | Cl2 | Fe |
A. A B. B C. C D. D
����Ŀ�����ݱ������ݣ��Ʋ���Ԫ�ص�ԭ�Ӱ뾶�����ǣ� ��
Ԫ�� | N | S | O | Si |
ԭ�Ӱ뾶/(10-10m) | 0.75 | 1.02 | 0.73 | 1.11 |
A.0.80��10-10mB.1.10��10-10m
C.1.20��10-10mD.0.70��10-10m