题目内容
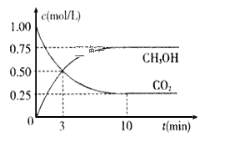
【题目】在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
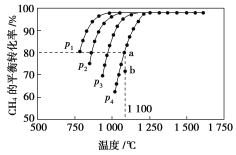
则:(1)该反应的ΔH________0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________。压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
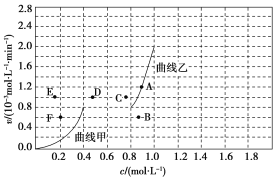
则:①与曲线v正~c(CH4)相对应的是上图中曲线______(填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
【答案】> p4>p3>p2>p1 > 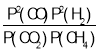 1.64 乙 B、F
1.64 乙 B、F
【解析】
(1)根据图示,压强不变时,升高温度,CH4的平衡转化率增大,说明平衡向正反应方向移动。根据升温时,平衡向吸热反应方向移动,可知正反应为吸热反应,ΔH>0;
(2)该平衡的正反应为气体分子数增大的反应,温度不变时,降低压强,平衡向正反应方向移动,CH4的平衡转化率增大,故p4>p3>p2>p1;压强为p4时,b点未达到平衡,反应正向进行,故v(正)>v(逆);
(3)由用平衡浓度表示的平衡常数类推可知,用平衡压强表示的平衡常数Kp=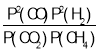 ;p4时a点CH4的平衡转化率为80%,则平衡时c(CH4)=c(CO2)=0.2mol·L-1,c(CO)=c(H2)=1.6mol·L-1,则p(CH4)=p(CO2)=p4×
;p4时a点CH4的平衡转化率为80%,则平衡时c(CH4)=c(CO2)=0.2mol·L-1,c(CO)=c(H2)=1.6mol·L-1,则p(CH4)=p(CO2)=p4×![]() =
=![]() p4,p(CO)=p(H2)=p4×
p4,p(CO)=p(H2)=p4×![]() =
=![]() p4,故Kp=
p4,故Kp=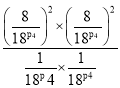 =
=![]() ≈1.64;
≈1.64;
(4)①CH4的浓度由1.0mol·L-1逐渐减小,而CO的浓度由0逐渐增加,故v正~c(CH4)相对应的曲线为乙;
②降低温度,正、逆反应速率均减小,平衡向逆反应方向移动,则CH4的浓度增大,而CO的浓度减小,故相应的平衡点分别为B、F。