题目内容
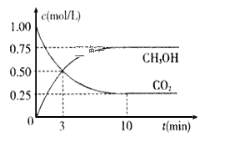
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答:
(1)写出该反应的平衡常数表达式_____________________。
(2)达到平衡状态的时刻是__________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_________mol/(L·min)。
(CO2)=_________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为____________。
(5)该温度下,反应的化学平衡常数数值是____________。
(6)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)
CH3OH(g) ΔH= -90.1kJ·mol-1 ②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
CO2(g)+H2(g) ΔH=-41.1kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_______________,反应在10 min内所放出的热量为_____kJ。
【答案】c(CH3OH)×c(H2O)/[ c(CO2)×c3(H2)] 10 0.075 16:13 0.67 CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ΔH=-49kJ/mol 73.5
CH3OH(g) +H2O(g) ΔH=-49kJ/mol 73.5
【解析】
根据图像可知,反应在10min时达到平衡,c(CO2)初始时为1mol/L,平衡时为0.25mol/L;c(CH3OH)平衡时为0.75mol/L;初始加入2mol CO2,则容器的体积为2L;则c(H2)初始时为3mol/L,平衡时为1.5mol/L。
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始:1 3 0 0
反应:0.75 1.5 0.75 0.75
平衡:0.25 1.5 0.75 0.75
(1)K=![]()
(2)反应在10min时各物质的浓度不再改变,达到平衡;
(3)在前10min内,![]() (CO2)=c/t=
(CO2)=c/t=![]() =0.075mol/(Lmin);
=0.075mol/(Lmin);
(4)恒温恒容条件下,压强之比等于物质的量之比,压强之比=8:6.5=16:13;
(5)K=![]() =
= ![]() =0.67;
=0.67;
(6)根据盖斯定律可知,①-②可得CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ΔH=-49kJ/mol;10min时,CO2反应1.5mol,释放49×1.5=73.5kJ。
CH3OH(g) +H2O(g) ΔH=-49kJ/mol;10min时,CO2反应1.5mol,释放49×1.5=73.5kJ。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】下列物质:①铜片 ②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧氨水。
⑧氨水。
(1)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)
分类标准 | 碱性氧化物 | 非电解质 | 弱酸 |
属于该类的物质 | ___________ | ___________ | ______________ |
(2)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)。
(3)在标准状况下,相同体积的②和④,其原子个数比为_________。
(4)写出氢氧化钡的电离方程式:______________。
(5)上述物质中有两种物质之间可发生离子反应:![]() ,该离子反应对应的化学方程式为:______________。
,该离子反应对应的化学方程式为:______________。