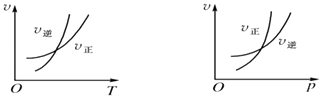��Ŀ����
����Ŀ��1774����仯ѧ�����������̿���Ҫ�ɷ��Ƕ������̣������Ṳ�ȵõ�����ɫ���壮�ס�������ͬѧ�ֱ��ȡ������Ӧԭ��������ȡһƿ��������������֤Cl2��ˮ��Ӧ���ò�������ʣ�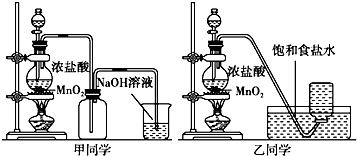
��ش�
��1��д��ʵ�����Ʊ������Ļ�ѧ����ʽ ��
��2��������ͬѧ��ʵ��װ�ã���Ҫֹͣʵ�飬�����˳���� �� ��ֹͣ���� ��ȡ������ƿ�Ǻ� �۽��������뵽�ռ���Һ��
��3���ס�����ͬѧ�ֱ����ռ����������м�������ˮ�������ֳ����ݣ�������֤������ˮ��Ӧ���ò������ʵ�����ʵ�飮ʵ������������ۼ�¼���£�
ʵ����� | ʵ����� | ���� | ���� |
�� | ��Ʒ����Һ | ��Һ��ɫ | ������ˮ��Ӧ�IJ�����Ư���� |
�� | ����NaHCO2��ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ�����н�ǿ������ |
������д�±����ۼס���ͬѧʵ��١��ڵĽ��ۣ������������
ʵ����� | �� | �� |
�� | ||
�� |
��4����ͬѧ�������Ϸ���HClO�������Դ���MnO2 �� �������������Լ���ʵ������ȡ����A��CaC12�ʹ�����B��Ũ����NaClO
C��Ũ����ʹ����� D������NaCl������NaClO��Ũ����
����Ϊ���������Լ������Լ�����ʵ�ʣ���Cl��ԭ����������ߣ���д�������Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2���ڢۢ�
��3��������������������������
��4��D��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4��
���������⣺��1��ʵ����������Ͷ��������ڼ��������·�Ӧ�Ʊ���������Ӧ�ķ���ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�� �ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O�� �ʴ�Ϊ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����2�������ж������ŷŵ������У���ֹͣ����������������������ͬѧ��ʵ��װ�ã�Ҫֹͣʵ�飬�����˳��Ϊ����ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ�
MnCl2+Cl2��+2H2O����2�������ж������ŷŵ������У���ֹͣ����������������������ͬѧ��ʵ��װ�ã�Ҫֹͣʵ�飬�����˳��Ϊ����ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ�
�ʴ�Ϊ���ڢۢ٣���3����ͬѧ�������ſ������ռ���������Ϊ�Ȼ�����лӷ��ԣ������ռ��������к��д������Ȼ��⣬�Ȼ�����̼�����Ʒ�Ӧ���ɶ�����̼���壬����ˮ�ɷֵļ�����ɸ��ţ���ͬѧ�Ʊ������������Ȼ��ⲻ�����ˮ�е��Ȼ���ļ�����ɸ��ţ�
�ʴ�Ϊ��
ʵ����� | �� | �� |
�� | ���� | ���� |
�� | ������ | ���� |
4��A��CaC12�ʹ����ᣬ������Ϊ���ᣬ��������������٣������Լ�������ʵ�ʣ�
B��Ũ����NaClO������Һ�У���������ˮ��ԭ�������ʵͣ������Լ�������ʵ�ʣ�
C��Ũ����ʹ����ᣬ������Ϊ���ᣬ��������������٣�����Һ�У���������ˮ��ԭ�������ʵͣ������Լ�������ʵ�ʣ�
D������NaCl������NaClO��Ũ���ᣬŨ���Ậˮ�����٣�������䷴Ӧ��ȡ��������ԭ�������ʸߣ���ӦΪ��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4������D����ʵ�ʣ�
�ʴ�Ϊ��D��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4����
��1������Ͷ��������ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����2������ʵ�������ȫ��β������Ҫ����ͬѧֹͣʵ��Ӧ��ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ���3����ͬѧ�������ſ������ռ���������Ϊ�Ȼ�����лӷ��ԣ������ռ��������к��д������Ȼ��⣬�Ȼ�����̼�����Ʒ�Ӧ���ɶ�����̼���壬����ˮ�ɷֵļ�����ɸ��ţ���ͬѧ�Ʊ������������Ȼ��ⲻ�����ˮ�е��Ȼ���ļ�����ɸ��ţ���4��A��CaC12�ʹ����ᣬ������Ϊ���ᣬ��������������٣�
B��Ũ����NaClO������Һ�У���������ˮ��ԭ�������ʵͣ�
C��Ũ����ʹ����ᣬ������Ϊ���ᣬ��������������٣�����Һ�У���������ˮ��ԭ�������ʵͣ�
D������NaCl������NaClO��Ũ���ᣬ��ԭ�������ʸߣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
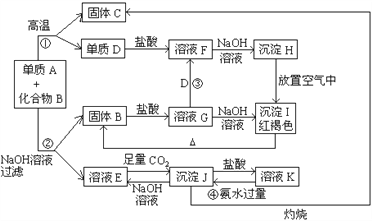
Сѧ��10����Ӧ����ϵ�д�����Ŀ��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����ã�
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+2AlCl3��g��+6C��s���T6AlCl��g��+6CO��g����H=akJmol��1
3AlCl��g���T2Al��l��+AlCl3��g����H=bkJmol��1
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��N2��g��+CO2��g����H=QkJmol��1 �� ��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��0��10min�ڣ�NO��ƽ����Ӧ����v��NO��= �� T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������������ĸ��ţ���
a��ͨ��һ������NO
b������һ�����Ļ���̿
c��������ʵĴ���
d���ʵ���С���������
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1����Q0���������������
���ھ��Ⱥ��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬������������ѡ���ţ���
a����λʱ��������2nmol NO��g����ͬʱ����nmol CO2��g��
b����Ӧ��ϵ���¶Ȳ��ٷ����ı�
c�����������ܶȲ��ٷ����ı�
d����Ӧ��ϵ��ѹǿ���ٷ����ı䣮