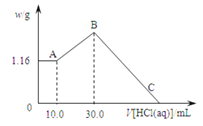
题目内容
【题目】将足量的二氧化锰与40 mL 10 mol/L浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比( )
A. 前者产生的Cl2多 B. 后者产生的Cl2多
C. 一样多 D. 无法比较
【答案】B
【解析】对于反应一:HCl物质的量为10mol/L×0.04L=0.4mol,将足量的二氧化锰与浓盐酸反应产生的氯气,随反应的进行,盐酸浓度降低,HCl不能完全反应,假定HCl完全反应,根据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知含HCl0.4mol浓盐酸完全反应生成氯气为0.1mol,实际氯气小于0.1mol;对于反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据方程式可知生成氯气为0.1mol,故反应二生成的氯气大于反应一生成的氯气,答案选B。
MnCl2+Cl2↑+2H2O可知含HCl0.4mol浓盐酸完全反应生成氯气为0.1mol,实际氯气小于0.1mol;对于反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据方程式可知生成氯气为0.1mol,故反应二生成的氯气大于反应一生成的氯气,答案选B。

【题目】1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应所得产物的性质.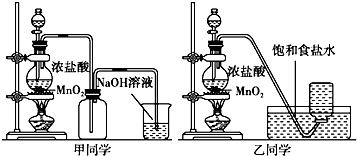
请回答:
(1)写出实验室制备氯气的化学方程式 .
(2)对于乙同学的实验装置,若要停止实验,其操作顺序是 . ①停止加热 ②取出集气瓶盖好 ③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验.实验操作、现象、结论记录如下:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你填写下表评价甲、乙同学实验①、②的结论(填合理或不合理)
实验序号 | 甲 | 乙 |
① | ||
② |
(4)丙同学查阅资料发现HClO的氧化性大于MnO2 , 拟用下列四组试剂在实验室制取氧气A.CaC12和次氯酸B.浓盐酸NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四种试剂中组试剂符合实际,且Cl的原子利用率最高.试写出这个反应的化学方程式 .
【题目】拟用下图所示装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂)能达到实验目的的是( )
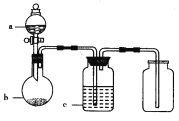
选项 | 气体 | a | b | c |
A | H2 | 稀硫酸 | 锌 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 |
C | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
D | NO | 稀硝酸 | 铜 | 浓硫酸 |
A. A B. B C. C D. D