题目内容
【题目】由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
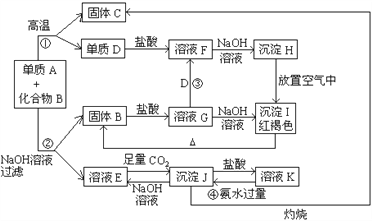
请回答:
(1)A的化学式____________; B的化学式_____________
(2)反应①的化学方程式_____________________________________________
(3)检验溶液F中阳离子的方法是_________________________________
(4)反应③的离子方程式_____________________________________________
(5)反应④的离子方程式_____________________________________________
【答案】 Al Fe2O3 2Al+Fe2O3=2Fe+Al2O3 加KSCN溶液不变红色,加氯水变红色(或其他合理答案) 2Fe3++Fe=3Fe2+ Al3++3NH·H2O=Al(OH)3↓+3NH4+
【解析】第一个“突破口”是红褐色沉淀I为Fe(OH)3,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;第二个“突破口”是利用E、J、K之间的转化关系,结合有关知识和直觉判断E为NaAlO2,J为Al(OH)3,K为AlCl3,最后推出A、B、C。
(1)正确答案:Al;Fe2O3;
(2)铝和氧化铁加热条件下发生置换反应生成氧化铝和铁;正确答案:2Al+Fe2O3=2Fe+Al2O3
(3)Fe2+的检验方法:加入氢氧化钠溶液,生成白色沉淀变为灰绿色,最后变为红褐色;或者加KSCN溶液不变红色,加氯水变红色溶液;正确答案:加KSCN溶液不变红色,加氯水变红色;(或其他合理答案)
(4)Fe3+被Fe还原为Fe2+ ;正确答案:2Fe3++Fe=3Fe2+;
(5)氢氧化铝沉淀不溶于过量的氨水;正确答案:Al3++3NH·H2O=Al(OH)3↓+3NH4+;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应所得产物的性质.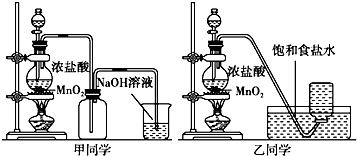
请回答:
(1)写出实验室制备氯气的化学方程式 .
(2)对于乙同学的实验装置,若要停止实验,其操作顺序是 . ①停止加热 ②取出集气瓶盖好 ③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验.实验操作、现象、结论记录如下:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你填写下表评价甲、乙同学实验①、②的结论(填合理或不合理)
实验序号 | 甲 | 乙 |
① | ||
② |
(4)丙同学查阅资料发现HClO的氧化性大于MnO2 , 拟用下列四组试剂在实验室制取氧气A.CaC12和次氯酸B.浓盐酸NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四种试剂中组试剂符合实际,且Cl的原子利用率最高.试写出这个反应的化学方程式 .

