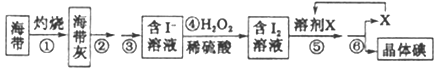
题目内容
【题目】物质结构决定物质性质,回答下列涉及物质结构和性质的问题。
(1)笫二周期中,元素的第一电离能处于B与N之间的元素有______ 种。
(2)某元素位于第四周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为___________。
(3)AlC13是有机合成和石油化工的催化剂,已知AlCl3可以通过配位键形成具有桥式结构的双聚分子Al2Cl6,Al2Cl6分子的结构式为_________。
(4)KCN可被H2O2氧化为KOCN。KOCN可作为制药材料,其晶体类型是________,碳原子采取sp杂化,1mol该物质中含有的π键数目为______;H2O2常温下是液体,沸点较高(150℃),其主要原因是____________。
(5)氮化硼(BN)和磷化硼(BP)都是受到高度关注的耐磨涂料,它们结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是________。
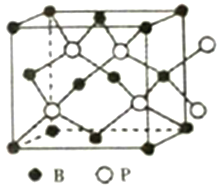
(6)磷化硼晶体的晶胞结构如图所示,在BP晶胞中B原子的堆积方式为______,若图中立方体的边长为a pm,则磷化硼中硼原子和磷原子之间的最近距离为__________。
【答案】 3 3d84s2 ![]() 或
或![]() 离子晶体 2NA 分子间存在氢键 由于二者形成的晶体都是原子晶体,而磷原子的半径比氮原子大,N—B共价键键长比B——P小,N—B共价键键能大,因此氮化硼晶体的熔点要比磷化硼晶体高。 面心立方堆积
离子晶体 2NA 分子间存在氢键 由于二者形成的晶体都是原子晶体,而磷原子的半径比氮原子大,N—B共价键键长比B——P小,N—B共价键键能大,因此氮化硼晶体的熔点要比磷化硼晶体高。 面心立方堆积 ![]() 或
或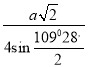
【解析】(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2;
(3)Cl原子最外层有7个电子,只能与Al原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构.Al原子最外层有3个电子,可分别与3个Cl原子形成共价键,因而Cl原子与2个Al原子形成的化学键中,必有1个是配位键,由于电子对由Cl原子提供,这样Cl原子最外层电子数仍为8,Al原子最外层也成为8电子结构,则Al2Cl6分子的结构式为![]() 或
或![]() ;(4) KOCN是由活泼金属和非金属构成的属于离子晶体,C能形成的4个共价键,已知其杂化方式为sp杂化,说明含有2个δ键即有2个价层电子对,另外的2个共价键为π键,所以1mol该物质中含有的π键数目为2NA;②H2O2分子之间存在氢键,使其沸点较高;
;(4) KOCN是由活泼金属和非金属构成的属于离子晶体,C能形成的4个共价键,已知其杂化方式为sp杂化,说明含有2个δ键即有2个价层电子对,另外的2个共价键为π键,所以1mol该物质中含有的π键数目为2NA;②H2O2分子之间存在氢键,使其沸点较高;
(5)原子晶体中,物质熔点与原子半径、键长成反比,磷原子的半径比氮原子大,N-B共价键键长比B-P小,键能大,所以氮化硼晶体的熔点要比磷化硼晶体高;
(6)由晶胞结构可知,B原子处于晶胞顶点与面心,在BP晶胞中B的堆积方式为面心立方最密堆积,P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的![]() ,立方体的每条边长为a pm,则晶胞体对角线长为
,立方体的每条边长为a pm,则晶胞体对角线长为![]() apm,则P原子与B原子最近距离为
apm,则P原子与B原子最近距离为![]() apm×
apm×![]() =
=![]() pm。
pm。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案