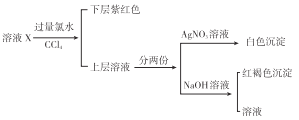
题目内容
【题目】已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断不正确的是
A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 实验①中,用160 mL10 mol/L的浓盐酸与足量KMnO4充分反应,标准状况下可制得11.2 L的Cl2
C. 实验①生成的气体能使湿润的淀粉KI试纸变蓝
D. 实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水和浓硫酸
【答案】B
【解析】A、在氧化还原反应中氧化剂的氧化性强于氧化产物的,所以根据反应的现象可知,氧化性强弱顺序是KMnO4>Cl2>Fe3+>I2,选项A正确;B、实验①中发生的反应为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,则用160 mL10 mol/L的浓盐酸与足量KMnO4充分反应,标准状况下可制得Cl2的体积为: ![]() =89.6L,选项B错误;C、实验①生成的气体是氯气,氯气将KI中的碘离子氧化生成碘单质,碘单质使淀粉变蓝,选项C正确;D、实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水除去氯化氢,通过浓硫酸干燥,选项D正确。答案选B。
=89.6L,选项B错误;C、实验①生成的气体是氯气,氯气将KI中的碘离子氧化生成碘单质,碘单质使淀粉变蓝,选项C正确;D、实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水除去氯化氢,通过浓硫酸干燥,选项D正确。答案选B。

【题目】(1)CH3COOH是最常见的有机弱酸。
①CH3COOH的电离方程式为_____________。
②CH3COONa溶液呈碱性,原因是__________(填“CH3COO-”或“Na+”)水解引起的。
③ 在CH3COONa溶液中,c(Na+)_______c(CH3COO-)、(填“>”“=”或“<”)
(2)已知:反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=131.3kJ/mol
CO(g)+H2(g)的△H=131.3kJ/mol
① 该反应是反应__________(填“吸热”或“放热”)。
② 若反应消耗24gC(s),则反应的热效应为__________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol 通入容积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
① 2 min 内,vCO=__________。
② 该温度下,此反应的平衡常数表达式K=_________。
③ 其他条件不变,再充入0.1molCO和0.1molH2O(g),达到平衡时CO 的休积分数_____(填“增大”、“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极,请回答下列问题:
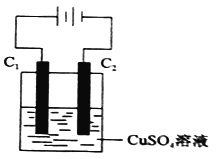
① C1作_________(填“阳极”或”阴极”)。
② C2极电极反应式为____________。