题目内容
【题目】(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)![]() CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
【答案】(1)①< ②向正反应方向进行
(2) CH3OH+ 8OH—-6e—= CO32—+6H2O;减小
(3) 2Cl—-2e—=Cl2↑;56 (每格2分,共12分)
【解析】
试题分析:(1)①由表中所给平衡常数与温度关系可知,温度升高平衡常数减小,说明平衡逆向移动,故逆向为吸热方向,正向为放热反应,故ΔH<0;②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,可得Qc=1/9<K(300)故反应向正反应方向进行;(2)甲醇燃料碱性电池中负极为甲醇放电:CH3OH+ 8OH—-6e—= CO32—+6H2O;总反应为: 2CH3OH+3O2+4OH-=2CO32-+6H2O,随着反应的不断进行溶液的pH减小;(3)石墨作两极电解饱和食盐水,阳极Cl—放电:2Cl—-2e—=Cl2↑,电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则消耗n(H+)=0.01mol,故转移电子为0.01mol,则消耗氧气0.0025mol,体积为56mL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某同学配制480 mL 0.5 mol/L NaOH溶液。
⑴ 该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管___________。
⑵ 其操作步骤如乙图所示,则甲图操作应在乙图中的____(填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


⑶ 该同学应称取NaOH固体___g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
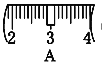
并在下图中选出能正确表示游码位置的选项____(填大写字母)。
附表:砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

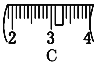
⑷ 该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是____(填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度