题目内容
10.0.5mol H3PO4的质量是49g,含0.5NA个H3PO4分子,含2mol氧原子.分析 根据m=nM,N=nNA,n(O)=n(H3PO4)×4计算.
解答 解:0.5mol H3PO4的质量是m=nM=0.5mol×98g/mol=49g,N=nNA=0.5NA,n(O)=n(H3PO4)×4=0.5mol×4=2mol;
故答案为:49;0.5NA;2.
点评 本题考查了物质的量的有关计算,注意求分子中原子的物质的量时,只有明确分子与原子之间的关系才能正确解答,题目难度不大.

练习册系列答案
相关题目
7.下列反应的离子方程式书写正确的是( )
| A. | 向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 | |
| D. | 以石墨作电极电解CuCl2溶液:2Cl-+2H2O═2OH-+Cl2↑十H2↑ |
1.下列反应方程式中,正确的是( )
| A. | 碳酸氢镁与足量的氢氧化钠溶液反应:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 氧化铝和过量的烧碱溶液反应:Al2O3+3OH-═2AlO2-+H2O | |
| C. | 氯化铝溶液与少量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 向碳酸钙中滴加醋酸溶液:CaCO3+2H+═Ca2++H2O+CO2↑ |
5.某铁矿石样品的主要成分为铁的氧化物,还含有少量SiO2.某化学兴趣小组对该铁矿石中铁元素的价态及含量进行如下探究:
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
③问题讨论:
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
15.若某原子的摩尔质量是Mg/mol,则一个该原子的实际质量为( )
| A. | Mg | B. | $\frac{1}{M}$g | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | $\frac{6.02×1{0}^{23}}{\;}$g |
2.下列有关操作或判断正确的是( )
| A. | 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平称取25.20 g NaCl | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线读数会导致所配溶液浓度偏高 |
19.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
20.下列叙述正确的是( )
| A. | 相同浓度的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,铵根浓度大小关系为(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl | |
| B. | 向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 | |
| C. | 0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 | |
| D. | 0.2 mol/L的NaHCO3溶液中c(H+)+c(Na+)═c(CO32-)+c(OH-)+c(HCO3-) |
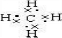 ,空间构型是正四面体,丙烷的结构简式为:CH3CH2CH3异丁烷的结构简式CH3CH(CH3)CH3
,空间构型是正四面体,丙烷的结构简式为:CH3CH2CH3异丁烷的结构简式CH3CH(CH3)CH3