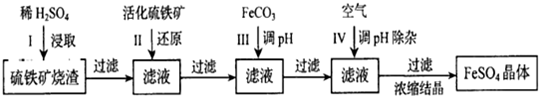
题目内容
7.下列反应的离子方程式书写正确的是( )| A. | 向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 | |
| D. | 以石墨作电极电解CuCl2溶液:2Cl-+2H2O═2OH-+Cl2↑十H2↑ |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.反应生成碳酸氢钙、HClO;
C.物质的量比为2:2.5=4:5,由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化;
D.电解生成Cu和氯气.
解答 解:A.向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O,故A错误;
B.次氯酸钙溶液中通入过量二氧化碳的离子反应为ClO-+CO2+H2O═HCO3-+HClO,故B错误;
C.1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2,由电子守恒可知离子反应为4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2,故C正确;
D.以石墨作电极电解CuCl2溶液的离子反应为2Cl-+Cu2+$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
17.(1)在下列物质中:
①CH≡C-CH2-CH3 ②C3H8 ③CH3-C≡C-CH2-CH3 ④1,3-戊二烯
⑤甲基环丁烷 ⑥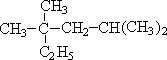 ⑦
⑦ ⑧
⑧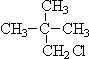
属于同系物的是①和③、②和⑥,
属于同种物质的是⑦⑧,
属于同分异构体的是③④.
(2)下列表中括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,将所选的试剂及装置的编号填入表中,
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
①CH≡C-CH2-CH3 ②C3H8 ③CH3-C≡C-CH2-CH3 ④1,3-戊二烯
⑤甲基环丁烷 ⑥
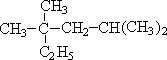 ⑦
⑦ ⑧
⑧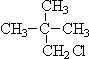
属于同系物的是①和③、②和⑥,
属于同种物质的是⑦⑧,
属于同分异构体的是③④.
(2)下列表中括号内的物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,将所选的试剂及装置的编号填入表中,
试剂:a.水,b.氢氧化钠,c.食盐,d.溴水,e.生石灰,f.溴的四氯化碳溶液
分离装置:A.分液装置,B.过滤装置,C.蒸馏装置,D.洗气装置
| 需加入的试剂 | 分 离 装 置 | |
| 1-氯丙烷(乙醇) | ||
| 乙烷(乙烯) | ||
| 苯(苯酚) | ||
| 硬脂酸钠溶液(甘油) | ||
| 溴化钠溶液(碘化钠) |
18.鉴别乙醇、乙醛、乙酸应选用的试剂最好是( )
| A. | Na2CO3溶液 | B. | 汽油 | C. | 水 | D. | 新制Cu(OH)2悬浊液 |
2.“5•12”地震给四川等省市人民群众带来巨大的灾难.在灾区经常发生因混合使用消毒剂或洁污剂而产生的氯气中毒事件,据此推测,产生类似中毒事件的相混合的洁污剂或消毒剂中最有可能含有的离子或物质是( )
| A. | ClO3-,Cl-,K+ | B. | ClO-,Cl-,H+ | ||
| C. | NaClO,NaClO3,NaNO3 | D. | NaClO,Na2SO4,NaCl |
9.可以鉴别CH4、CO、H2的方法是( )
| A. | 点燃--通入澄清石灰水--加溴水 | |
| B. | 点燃--罩上干燥烧杯--通入澄清石灰水 | |
| C. | 点燃--通入澄清石灰水 | |
| D. | 点燃--通入酸性KMnO4溶液 |
 有X、Y、Z三种物质,它们之间存在如图转化关系:
有X、Y、Z三种物质,它们之间存在如图转化关系: ;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.
;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.