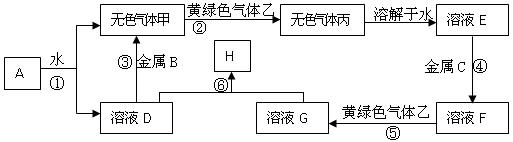
题目内容
铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
(1)配平制取铁酸钠的化学方程式:
□Fe(NO3)3+□NaOH+□Cl2——□Na2FeO4+□NaNO3+□NaCl+□H2O
反应中_____________________元素被氧化,转移电子总数为__________________________。
(2)铁酸钠之所以能净水,除了能消毒杀菌外,另一个原因是________________________
_______________________________________________________________________________。
(1)配平制取铁酸钠的化学方程式:
□Fe(NO3)3+□NaOH+□Cl2——□Na2FeO4+□NaNO3+□NaCl+□H2O
反应中_____________________元素被氧化,转移电子总数为__________________________。
(2)铁酸钠之所以能净水,除了能消毒杀菌外,另一个原因是________________________
_______________________________________________________________________________。
(1)Fe(OH)3 (2)取少量水样于试管中,滴加适量氯水后,再滴加数滴NH4SCN或KSCN溶液,若溶液呈血红色,即为该井水
2Fe2++Cl2====2Fe3++2Cl-,
Fe3++SCN-====[Fe(SCN)]2+
(3)取少量水样于试管中,加入少量BaCl2溶液,如产生明显白色浑浊,即为明矾处理后的水 Ba2++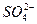 ====BaSO4↓
====BaSO4↓
2Fe2++Cl2====2Fe3++2Cl-,
Fe3++SCN-====[Fe(SCN)]2+
(3)取少量水样于试管中,加入少量BaCl2溶液,如产生明显白色浑浊,即为明矾处理后的水 Ba2++
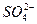 ====BaSO4↓
====BaSO4↓(1)从棕红色絮状沉淀较易推断出“锈皮”的主要成分是Fe(OH)3。
(2)根据井水久置后的变化,可知水中含有Fe2+、Fe3+,所以可通过鉴别Fe2+、Fe3+来鉴别这种井水。实验原理是:先用Cl2等氧化剂把Fe2+氧化成Fe3+,再用KSCN与Fe3+反应生成红色的[Fe(SCN)]2+来鉴别。
(3)明矾处理后的水中有较多的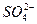 ,故实验目的可转换为鉴别有无
,故实验目的可转换为鉴别有无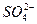 。利用
。利用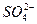 与Ba2+生成难溶的BaSO4,可选用可溶性钡盐或氢氧化钡溶液来鉴别。
与Ba2+生成难溶的BaSO4,可选用可溶性钡盐或氢氧化钡溶液来鉴别。
(2)根据井水久置后的变化,可知水中含有Fe2+、Fe3+,所以可通过鉴别Fe2+、Fe3+来鉴别这种井水。实验原理是:先用Cl2等氧化剂把Fe2+氧化成Fe3+,再用KSCN与Fe3+反应生成红色的[Fe(SCN)]2+来鉴别。
(3)明矾处理后的水中有较多的
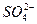 ,故实验目的可转换为鉴别有无
,故实验目的可转换为鉴别有无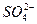 。利用
。利用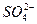 与Ba2+生成难溶的BaSO4,可选用可溶性钡盐或氢氧化钡溶液来鉴别。
与Ba2+生成难溶的BaSO4,可选用可溶性钡盐或氢氧化钡溶液来鉴别。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
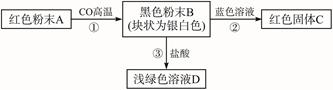
相关题目
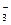 、Cl-、Al3+
、Cl-、Al3+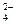 、NO
、NO
 的物质的量浓度之比为( )
的物质的量浓度之比为( )