题目内容
【题目】氯气及许多含氯化合物是生产、生活中应用非常广泛的物质。磺酰氯(SO2Cl2)是实验室中常见试剂。已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
(1)在2 L恒容密闭耐腐蚀性的容器中充入0.1 mol SO2Cl2(g)发生反应,在101 kPa、375K条件下进行该反应,SO2Cl2的转化率与时间关系如图所示。
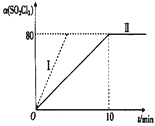
①平衡时,容器内压强p=_________________。
②相对曲线Ⅱ对应实验,仅改变一个条件得到曲线I,曲线I改变的条件可能是_____________________。
(2)一定量氯气用饱和纯碱溶液吸收恰好只生成三种盐(不产生气体),该溶液中阴离子浓度大小顺序为______________________________________________________。
(3)已知:常温下,次氯酸(HClO)的电离常数Ka=2.5×10-8,则在该温度下,NaClO水解反应的水解常数Kh为______________________________。
【答案】181.8 kPa 加入催化剂 c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-) 4.0×10-7
【解析】
根据化学反应方程式,分析反应初始状态、平衡状态时各物质的物质的量的变化,进而进行物质的量计算;根据图像已知信息分析解答;根据盐类的水解原理分析解答。
(1) ① SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
初始 0.1mol 0 0
平衡时反应了0.1mol×80% 0.08mol 0.08mol
平衡时容器
中剩余 0.02mol 0.08mol 0.08mol
体积不变的容器中,压强之比等于物质的量之比,所以得到![]() ,P=181.8 kPa;
,P=181.8 kPa;
故答案为:181.8 kPa;
②从图像中可知,曲线Ⅱ与曲线I平衡时的转化率相同,只是反应达到平衡的时间减少,即加快了化学反应速率,所以曲线I的反应中是加入了催化剂;
故答案为:加入催化剂;
(2)氯气与碳酸钠溶液反应离子方程式为:Cl2 +2CO32- + H2O=Cl- + ClO- + 2HCO3-,从化学计量数上可以判断出c(HCO3-)最大,c(CO32-)最小,ClO-会发生水解,所以c(Cl-)> c(ClO-),该溶液中阴离子浓度大小顺序为:c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-);
故答案为:c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-);
(3)根据公式Kh=![]() =
=![]() =4.0×10-7;
=4.0×10-7;
故答案为:4.0×10-7。

 阅读快车系列答案
阅读快车系列答案【题目】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)K+的结构示意图为___。
(2)在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4,弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,若将该反应设计成原电池,则负极反应式为___。
(3)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol.L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。

AB段反应速率增大的原因可能是___(填字母)。
a.该反应是放热反应
b.反应物浓度增大
c.K2SO4起催化作用
d.MnSO4起催化作用
(4)为了探究外界条件对化学反应速率的影响,设计如下方案:
实验 | 0.1mol·L-1KMnO4/mL | 0.5mol·L-1H2C2O4/mL | 0.1mol·L-1H2SO4/mL | 水浴 温度/℃ | 蒸馏水 /mL | 褪色时间 /min |
I | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
II | 5.0 | 10.0 | 5.0 | 35 | V | t2 |
III | 5.0 | 15.0 | 3.0 | 35 | 2.0 | t3 |
IV | 5.0 | 15.0 | 5.0 | 45 | 0 | t4 |
①V=___。
②该实验方案不能探究对反应速率有影响的因素是___。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t4<t1,则实验结论是___。