题目内容
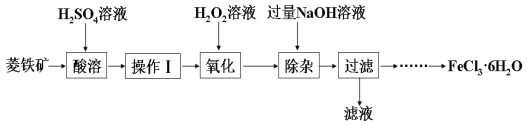
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
下列说法正确的是

A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数增大
【答案】AC
【解析】
A.由图可知,当n(H2)/n(CO)=1.5时,CO 的转化率a>b且大于T3下对应的CO 的转化率,当在温度为T3是随着n(H2)/n(CO)增大,CO 的转化率增大,H2 的转化率减小,所以a>b>c,故A正确;
B.根据CO(g)+2H2(g) ![]() CH3OH(g) △H<0,温度越高,CO 的转化率越小,由图可以看出,当n(H2)/n(CO)相等时,应有T3>T2>T1,故B错误;
CH3OH(g) △H<0,温度越高,CO 的转化率越小,由图可以看出,当n(H2)/n(CO)相等时,应有T3>T2>T1,故B错误;
C.a点时,CO的转化率为50![]() ,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,反应中CO的转化率为50
,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,反应中CO的转化率为50![]() ,由此可计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH时的浓度商Qc=4,所以平衡不移动,故C正确;
,由此可计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH时的浓度商Qc=4,所以平衡不移动,故C正确;
D.c点状态下再通入1 molCO和4 mol H2,在等温等容的条件下,投料比不变,相当于加压,平衡向正反应方向移动,新平衡中H2的体积分数减小,故D错误;
本题答案为AC。

【题目】现用0.1000 mol·L1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4+5H2C2O4+6H+![]() 2Mn2++10CO2↑+8H2O。填空完成问题:
2Mn2++10CO2↑+8H2O。填空完成问题:
(1)该滴定实验必需的玻璃仪器有______________。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
E.铁架台 F.滴定管夹 G.白纸 H.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________。
(3)滴定终点的现象为_________________________________________________________。
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为____mL,终点读数为_____mL。

(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数