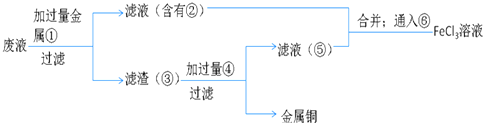
题目内容
【题目】硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性SeS,第一电离能SeAs(填“>”或“<”)
(3)H2Se的分子构型是 , 其中Se的杂化轨道类型是 .
(4)H2O的沸点(100℃)高于H2Se的沸点(﹣42℃)其原因是 .
(5)晶体Zn为六方最密堆积,其配位数是 .
(6)ZnSe晶胞如图,假设阿伏伽德罗常数值为NA , 则144gZnSe晶体中的晶胞数是 . 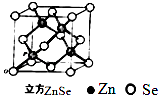
【答案】
(1)3d104s2
(2)<;<
(3)V形;sp3
(4)H2O含有氢键、H2Se不含氢键
(5)12
(6)![]()
【解析】解:(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为3d104s2 , 所以答案是:3d104s2;(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性Se<S;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Se<Sn,所以答案是:<;<;(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式分别为V形、sp3 ,
所以答案是:V形;sp3;(4)含有氢键的氢化物熔沸点较高,H2O含有氢键、H2Se不含氢键,导致H2O的沸点(100℃)高于H2Se的沸点(﹣42℃),所以答案是:H2O含有氢键、H2Se不含氢键;(5)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图 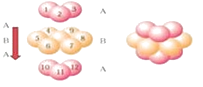
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,所以答案是:12;(6)该晶胞中Zn原子个数为4、Se原子个数=8× ![]() +6×
+6× ![]() =4,所以该晶胞质量=(
=4,所以该晶胞质量=( ![]() )g,晶胞个数=
)g,晶胞个数= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.

【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 , 很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 .
(2)操作Ⅱ中红色褪去的可能原因是 .
(3)用反应2MnO4﹣+5H2O2+6H+=2Mn2++502↑+8H2O测定溶液a中H2O2含量.取20.00mL溶液a,用稀(填化学式)酸化,用0.002molL﹣1KMnO4溶液滴定,至终点时平均消耗10.00mLKMnO4溶液.滴定时KMnO4溶液应装在(填酸或碱)式滴定管中,终点确定的方法是 , 经计算溶液a中c(H2O2)=molL﹣1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为 .
(5)向FeSO4溶液中加入一定量Na202固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 .