题目内容
【题目】某结晶水合物含有CO32-、SO42-、SO32-、Fe2+、Fe3+、NH4+、Ba2+中的三种离子,实验小组为确定其化学式做了如下实验:
①准确称取6.125g样品,配制成250.00mL溶液X。
②取20.00mL溶液X,加入足量盐酸,无明显现象;再加足量BaCl2溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体0.5825g。
③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL。
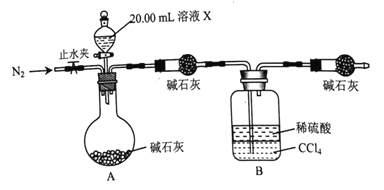
④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g。
⑤取少量溶液X,滴加0.1 mol ·L-1 KSCN溶液无明显现象,再向其中滴加0.1mol·L-1AgNO3溶液,有白色沉淀生成。
回答下列问题;
(1)完成实验①所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________________。
(2)实验③达到滴定终点的现象是________________________________________。
(3)实验④的反应结束后,打开止水夹通入N2的作用是_________________________。
(4)根据以上实验数据计算该结晶水合物的化学式为_________________________。
(5)某同学查阅资料发现 AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了如图实验装置并进行下列实验。
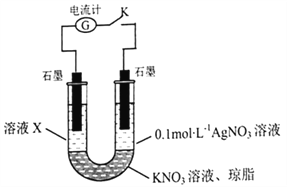
先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________(用离子方程式表示),该实验设计的优点是_______________。
【答案】 250mL容量瓶、胶头滴管![]() 当最后一滴KMnO4标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收 (NH4)2Fe(SO4)2·6H2O 溶液中无Fe3+ Fe2+的还原性强于SCN- Fe3++3SCN-=Fe(SCN)3 氧化性、还原性离子不直接接触。避免发生沉淀反应而导致离子浓度降低
当最后一滴KMnO4标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化 使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收 (NH4)2Fe(SO4)2·6H2O 溶液中无Fe3+ Fe2+的还原性强于SCN- Fe3++3SCN-=Fe(SCN)3 氧化性、还原性离子不直接接触。避免发生沉淀反应而导致离子浓度降低
【解析】(1)准确称取6.125g样品,配制成250.00mL溶液X时,用烧杯溶解药品,用托盘天平称量药品,用胶头滴管定容,需要用到的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;(2)实验③用0.01000mol·L-1KMnO4溶液滴定,达到滴定终点的现象是当最后一滴KMnO4标准溶液滴入时,溶液颜色变为浅紫红色,且半分钟内不再发生变化;(3)实验④的反应结束后,打开止水夹通入N2,使锥形瓶中产生的氨气完全进入B装置中被稀硫酸吸收;(4)②取20.00mL溶液X,加入足量盐酸,无明显现象说明不含CO32-、SO32-;再加足量BaCl2溶液,产生白色沉淀说明含有SO42-,不含Ba2+;将沉淀过滤、洗涤、干燥至恒重,得白色固体硫酸钡0.5825g,即![]() ,则250.00mL溶液X中含n(SO42-)=
,则250.00mL溶液X中含n(SO42-)=![]() ,m(SO42-)=
,m(SO42-)=![]() ,③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL,根据反应MnO4-+ 5Fe2++8H+=Mn2++ 5Fe3++4H2O可知,则250.00mL溶液X中含n(Fe2+)=
,③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL,根据反应MnO4-+ 5Fe2++8H+=Mn2++ 5Fe3++4H2O可知,则250.00mL溶液X中含n(Fe2+)=![]() ,m(Fe2+)=
,m(Fe2+)=![]() ,④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g,则n(NH4+)= n(NH3)=
,④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g,则n(NH4+)= n(NH3)=![]() ,m(NH4+)=
,m(NH4+)=![]() ,故所含结晶水的质量为6.125g-3.00g-0.875g-0.5625g=1.6875g,n(H2O)=
,故所含结晶水的质量为6.125g-3.00g-0.875g-0.5625g=1.6875g,n(H2O)=![]() ,n(NH4+):n(Fe2+):n(SO42-):n(H2O)=
,n(NH4+):n(Fe2+):n(SO42-):n(H2O)=![]() ,故该结晶水合物的化学式为(NH4)2Fe(SO4)2·6H2O;(5) 先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明溶液中无Fe3+;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是Fe2+的还原性强于SCN-,溶液变红的原因是Fe3++3SCN-=Fe(SCN)3,该实验设计的优点是氧化性、还原性离子不直接接触。避免发生沉淀反应而导致离子浓度降低。
,故该结晶水合物的化学式为(NH4)2Fe(SO4)2·6H2O;(5) 先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明溶液中无Fe3+;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是Fe2+的还原性强于SCN-,溶液变红的原因是Fe3++3SCN-=Fe(SCN)3,该实验设计的优点是氧化性、还原性离子不直接接触。避免发生沉淀反应而导致离子浓度降低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案