题目内容
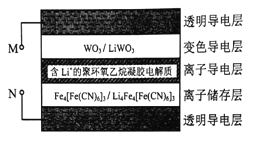
【题目】[化学——选修3:物质结构与性质] ![]()
磷酸铁锂电池对环境无污染,为绿色环保型电池,是铅酸电池的替代品,该电池的总反应为:
Li1-x FePO4+LixC6= LiFePO4+C6
(1)基态Fe2+的核外电子排布式为___________,与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),磷酸铁锂电池总反应中涉及到的C、O元素,第一电离能较大的是____________________。
(2)PO43-的空间构型是____________________。
(3)与PCl5互为等电子体的一种分子的化学式为_________。
(4)二乙烯三胺五乙酸铁-钠络合物结构如图所示,其中C原子的杂化方式为_______________。

![]()
(5)亚铁氰化钾经氯气或电解氧化,可得铁氰化钾K3Fe(CN)6],为红棕色晶体,也称赤血盐,1mol该物质含有的π键的数目为_____________。
(6)已知:LiF晶体与 NaCl晶体结构相同,F半径为0.133nm,Li+的半径为0.076nm,阴阳离子相接触,则一个晶胞中离子的空间占有率为_______ (列式并计算),分析说明该计算结果小于74.05%的原因_______。
【答案】 [Ar]3d6 K、Cr O ![]() 正四面体 AsF5或AsCl5 sp3;sp2 12NA 有LiF晶体中,正负离子直接相邻,
正四面体 AsF5或AsCl5 sp3;sp2 12NA 有LiF晶体中,正负离子直接相邻,![]() a=2(r++r-)=0.418(nm)
a=2(r++r-)=0.418(nm)
体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ![]() 阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%
阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%
【解析】(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,基态Fe2+的核外电子排布式为:[Ar]3d6;与Fe同周期的元素中,与铜原子最外层电子数相等的元素还有K、Cr;同周期第一电离能自左而右具有增大趋势,所以第一电离能较大的是O;(2)根据VSEPR理论,对于PO43-,成键原子数为BP=4,孤电子对数为VP=![]() =0,则其价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,为sp3杂化,空间构型为正四面体;(3) 等电子体是指具有相同价电子数目和原子数目的分子或离子,与PCl5互为等电子体的分子的化学式为AsF5或AsCl5;(4)在氨基乙酸铜的分子中-CH2-碳原子为sp3杂化,羰基碳原子为sp2杂化;(5)在CN-中碳原子与氮原子是以共价三键结合的,含有的2个π键。所以1 mol铁氰化钾K3Fe(CN)6]中含有的π键的数2
=0,则其价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,为sp3杂化,空间构型为正四面体;(3) 等电子体是指具有相同价电子数目和原子数目的分子或离子,与PCl5互为等电子体的分子的化学式为AsF5或AsCl5;(4)在氨基乙酸铜的分子中-CH2-碳原子为sp3杂化,羰基碳原子为sp2杂化;(5)在CN-中碳原子与氮原子是以共价三键结合的,含有的2个π键。所以1 mol铁氰化钾K3Fe(CN)6]中含有的π键的数2![]() NA;(6) 有LiF晶体中,正负离子直接相邻,a=2(r++r-)=0.418(nm),体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ;阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%。
NA;(6) 有LiF晶体中,正负离子直接相邻,a=2(r++r-)=0.418(nm),体积分数=4×(4π/3)×[(0.133)3+(0.076)3/0.4183=64.0% ;阴离子之间不直接接触,不再是紧密堆积。阴高了的空间占有率降至54%,阳离了的空间占有率仅为10%,所以总的空间占有率小于74.05%。

 优等生题库系列答案
优等生题库系列答案【题目】某研究性学习小组设计了如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
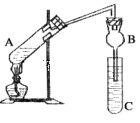
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(1)浓硫酸的作用是________________________________。
(2)球形管B除起冷凝作用外,另一重要作用是____________________________。
(3)反应中所用的乙醇是过量的,其目的是___________________。
(4)C中饱和碳酸钠溶液的作用__________________________________________。
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______________________;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。