题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为_______________。
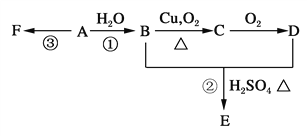
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如图所示:
为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为_____ (填“Na+”或“H+”或“OH-”)离子交换膜,该电池的阳极反应式为_______。
(3)用Cu2O做催化剂,工业上在一定条件一下,可以用一氧化碳与氢气反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)

①甲图是反反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_________。
②乙图表示该反应进行过程中能量的变化。请在乙图中画出用Cu2O作催化剂时“反应过程——能量”示意图_________。
③温度升高,该反应的平衡常数K_____(填“增大”、“不变”或“减小”)。
④ 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为_____(保留一位有效数字)。相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时,v(正)____v(逆)(填“大于”、“小于”或“等于”)。
⑤ 在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图丙表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有___________。
⑥ 据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_______(用化学方程式表示)。
【答案】 2CuO(s)+C(s) ![]() Cu2O(s)+CO(g) △H=+34.5kJ/mol OH- 2Cu-2e-+2OH-=CuO+H2O 0.15mol/(L·min)
Cu2O(s)+CO(g) △H=+34.5kJ/mol OH- 2Cu-2e-+2OH-=CuO+H2O 0.15mol/(L·min) 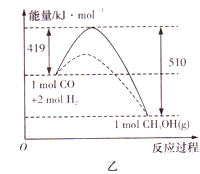 减小 2 大于 略 Cu2O+CO=2Cu+CO2
减小 2 大于 略 Cu2O+CO=2Cu+CO2
【解析】(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol,②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol,③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol,根据盖斯定律可知①+②-③×2即得到炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为2CuO(s)+C(s) ![]() Cu2O(s)+CO(g) △H=+34.5kJ/mol。(2)该电池的阳极是铜失去电子,转化为氧化亚铜,则反应式为2Cu-2e-+2OH-=Cu2O+H2O。由于阳极消耗氢氧根,所以该交换膜应为OH-离子交换膜。(3)①甲图中平衡时甲醇是0.75mol/L,则根据方程式可知消耗氢气是1.5mol/L,所以从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=1.5mol/L÷10min=0.15mol/(L·min)。②催化剂能降低活化能,但反应热不变,所以示意图为
Cu2O(s)+CO(g) △H=+34.5kJ/mol。(2)该电池的阳极是铜失去电子,转化为氧化亚铜,则反应式为2Cu-2e-+2OH-=Cu2O+H2O。由于阳极消耗氢氧根,所以该交换膜应为OH-离子交换膜。(3)①甲图中平衡时甲醇是0.75mol/L,则根据方程式可知消耗氢气是1.5mol/L,所以从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=1.5mol/L÷10min=0.15mol/(L·min)。②催化剂能降低活化能,但反应热不变,所以示意图为 。③反应物总能量高于生成物总能量,属于放热反应,温度升高,平衡向逆反应方向进行,该反应的平衡常数K减小。④
。③反应物总能量高于生成物总能量,属于放热反应,温度升高,平衡向逆反应方向进行,该反应的平衡常数K减小。④
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) x 2x x
平衡浓度(mol/L) 1-x 3-2x x
则1-x=0.2,解得x=0.8,所以该反应在该温度下的平衡常数为![]() ;相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时浓度熵为
;相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时浓度熵为![]() <2,所以反应向正反应方向进行,即v(正)大于v(逆)。⑤要降低甲醇含量,平衡逆向移动,可采取的措施有升温或减压。⑥反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,这说明CO2能与铜反应转化为氧化亚铜,方程式为Cu2O+CO=2Cu+CO2。
<2,所以反应向正反应方向进行,即v(正)大于v(逆)。⑤要降低甲醇含量,平衡逆向移动,可采取的措施有升温或减压。⑥反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,这说明CO2能与铜反应转化为氧化亚铜,方程式为Cu2O+CO=2Cu+CO2。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案