题目内容
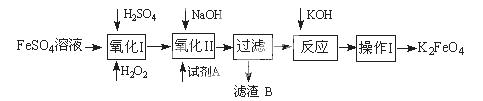
MnO2的一些性质或用途如图,下列说法正确的是 ( )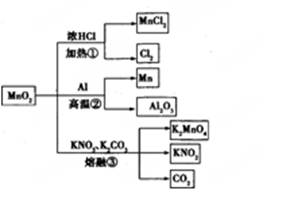
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
D
解析试题分析:A、①、②反应中MnO2均作氧化剂,③中Mn元素的化合价升高,则作还原剂,故A错误;B、足量MnO2与2L 10mol/LHCl共热,若完全反应可生成5mol Cl2,但随反应进行,浓盐酸变为稀盐酸,不再反应,则生成氯气小5mol,故B错误;C、反应②若生成1mol Al2O3,则由Al元素的化合价变化可知反应过程中转移1mol×2×(3-0)=6mol电子,故C错误;D、③中发生K2CO3+KNO3+MnO2=K2MnO4+KNO2+CO2↑,K2CO3和KNO3的化学计量数均为1,故D正确;故选D。
考点:考查氧化还原反应的有关判断与计算

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
将等物质的量的铁和铜的混台物24 g与600mL稀硝酸恰好完全反应,生成NO6 .72 L(标准状况)向反应后的溶液中加入l mol·L-1 NaOH溶液使金属离于恰好沉淀,过滤。下列有关说法错误的是
| A.混合物溶解后的溶液中 c(Fe3+): c(Fe2+) =1:1 |
| B.需加入NaOH溶液1000mL |
| C.稀硝酸的物质的量浓度是2 mol·L-1 |
| D.最后所得沉淀在空气中充分加热可得固体32 g |
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A.M | B.M2+ | C.M3+ | D.MO2+ |