题目内容
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
C
解析试题分析:已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为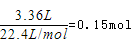 发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有1/2的Fe2+被氧化成Fe3+ 发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为
发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有1/2的Fe2+被氧化成Fe3+ 发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为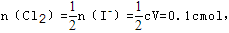
反应完成后溶液中有1/2的Fe2+被氧化成Fe3+ ,则与亚铁离子反应消耗的氯气为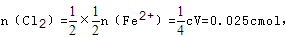 所以0.025cmol+0.1cmol=0.15mol
所以0.025cmol+0.1cmol=0.15mol
解得:c=1.2mol/L,
故选C.
考点:考查学生氧化还原反应的有关计算

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案MnO2的一些性质或用途如图,下列说法正确的是 ( )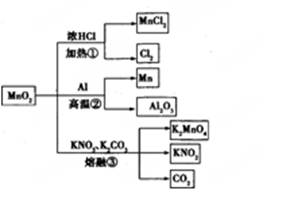
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
下列变化中,需加入适当氧化剂才能完成的是
| A.CuO → Cu | B.KCl→AgCl | C.Fe→FeCl3 | D.HNO3 → NO |
常温下,在水溶液中发生如下反应:( )
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。
下列说法错误的是
| A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行 |
| B.还原性由强到弱的顺序是C->A2+>B->X2+ |
| C.氧化性由强到弱的顺序是XO4->C2>B2>A3+ |
| D.反应③是置换反应 |
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
| A.9.6g | B.6.4 g | C.3.2 g | D.2.4 g |
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,从物质组成的角度看,不可能生成的产物是
| A.NaCl和O2 | B.NaClO3和NaClO |
| C.NaClO3和Cl2 | D.NaClO3和NaCl |
 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6