题目内容
中学常见的某反应的化学方程式为a+b→c+d+H2O(未配平,反应条件略去)。
请回答下列问题:
(1)若a是铁,b是稀硝酸(过量)且a可溶于c溶液中。则a与b反应的离子方程式为
(2)若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,写出其褪色过程的离子方程式为
(3)若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20g·mol-1的混合气体进行喷泉实验。假设溶质不扩散,实验完成后所得溶液的物质的量浓度为_ mol·L-1。(小数点后保留2位有效数字)
(4)若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5。则上述反应的离子方程式为 。
(1)Fe+4H++NO3-=Fe3++NO↑+H2O;
(2)SO2+Br2+2H2O=4H++SO42-+2Br-;
(3)0.045;
(4)4CO2+5OH-=CO32-+3HCO3- +H2O。
解析试题分析:(1)Fe可溶于c溶液中,可知C溶液为Fe3+的溶液;(2)可使澄清石灰水变浑浊的气体为SO2和CO2,其中SO2气体可以使溴水褪色;(3)C气体为NH3,进行喷泉实验进入烧瓶中水的体积等于原混合气体中氨气的体积,因此有c(NH3)=1/22.4=0.045mol·L-1;(4)造成温室效应的主要气体为CO2,c、d均为钠盐可判定其分别为Na2CO3和NaHCO3,因此结合物质的量之比为4:5可书写出化学方程式。
考点:离子方程式的书写和配平。

多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
(1)在表中①②空格处应分别填写_______、_______。
(2)①(CN)2和KOH溶液反应的化学方程式为:__________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
(1)填写下表
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式 (若无离子方程式,则写化学方程式) |
| Fe(Al) | | |
| SiO2(CaCO3) | | |
| CO2(HCl) | | |
| NaHCO3溶液(Na2CO3) | | |
| Na2CO3(NaHCO3) | | |
| Al2O3(Al(OH)3) | | |
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为 或 ,请分别写出发生反应的离子方程式 , 。
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
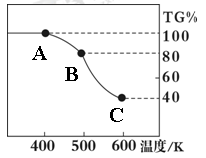
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
MnO2的一些性质或用途如图,下列说法正确的是 ( )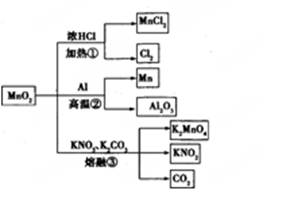
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |