题目内容
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |
D
解析试题分析:根据氧化还原反应理论,元素化合价升高作还原剂,元素化合价降低作氧化剂,所以Co2O3是氧化剂,Cl-是还原剂,Cl2是氧化产物,发生反应的化学方程式为Co2O3+6HCl= Cl2+3H2O+2CoCl2,氧化剂与还原剂的物质的量之比为1∶2,有3mol H2O生成,则同时生成1mol Cl2反应中有2mol电子转移,未指明标准状况,所以氯气的体积是2.24L时,氯气的物质的量不是0.1mol,转移的电子数不是0.1mol,所以D错误,答案选D。
考点:考查氧化还原反应理论的应用,反应的计算

多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
(1)在表中①②空格处应分别填写_______、_______。
(2)①(CN)2和KOH溶液反应的化学方程式为:__________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
MnO2的一些性质或用途如图,下列说法正确的是 ( )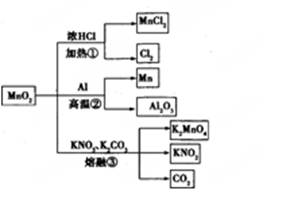
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
常温下,在水溶液中发生如下反应:( )
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。
下列说法错误的是
| A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行 |
| B.还原性由强到弱的顺序是C->A2+>B->X2+ |
| C.氧化性由强到弱的顺序是XO4->C2>B2>A3+ |
| D.反应③是置换反应 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中不一定含有Fe3+ |
| C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
| A.9.6g | B.6.4 g | C.3.2 g | D.2.4 g |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
下列反应中,H2O作还原剂的是
| A.2Na2O2+2H2O =" 4NaOH" + O2↑ | B.2F2+2H2O =" 4HF" + O2↑ |
| C.3NO2 + H2O =" NO" + 2HNO3 | D.3Fe+4H2O(g) 4H2+Fe3O4 4H2+Fe3O4 |