题目内容
13.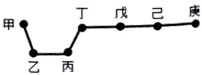 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
分析 短周期元素甲、乙、丙、丁、戊、己、庚,戊、己分别是空气、地壳中含量最多的元素,则戊为氮元素,己为氧元素,所以丁、戊、己、庚为第二周期元素,则乙、丙为第三周期元素,甲不一定在丁、庚的连线上,则甲为第一周期元素,则甲为氢元素,根据元素在周期表中位置关系可知,乙为镁元素,丙为铝,丁为碳元素,庚为氟元素,据此答题.
解答 解:短周期元素甲、乙、丙、丁、戊、己、庚,戊、己分别是空气、地壳中含量最多的元素,则戊为氮元素,己为氧元素,所以丁、戊、己、庚为第二周期元素,则乙、丙为第三周期元素,甲不一定在丁、庚的连线上,则甲为第一周期元素,则甲为氢元素,根据元素在周期表中位置关系可知,乙为镁元素,丙为铝,丁为碳元素,庚为氟元素,
A.根据上面的分析可知,甲为氢元素,为非金属元素,故A错误;
B.气态氢化物的稳定性HF>H2O>NH3,故B正确;
C.氢氧化镁与氢氧化铝不能反应,故C错误;
D.庚为氟元素,氟元素没有最高正价,故D错误;
故选B.
点评 本题考查结构性质位置关系,明确元素是解题关键,侧重对基础知识的巩固.

练习册系列答案
相关题目
3.下列反应属于吸热反应的是( )
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
4.某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一种电极的材料与电解质溶液的说明中肯定错误的是( )
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
1.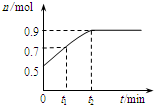 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
 一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )
一定温度下:在2.0L密闭容器中,发生X(g)?Y(g)+Z(g)△H<0,容器内反应物X的物质的量随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率为v(X)=$\frac{0.2}{{t}_{1}}$ mol/(L•min) | |
| B. | 反应达到平衡时,Y和Z的物质的量共减少0.8mol | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 反应到t2时刻后,保持其他条件不变,缩小容器的体积,再次平衡后,X的物质的量小于0.9mol |
8.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)除稀有气体外,元素中原子半径最大的是K,其离子的结构示意图为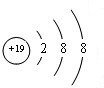
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为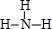 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为
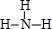 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
18.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 稀硫酸、澄清的石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
2.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
(1)推测反应Ⅲ是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.
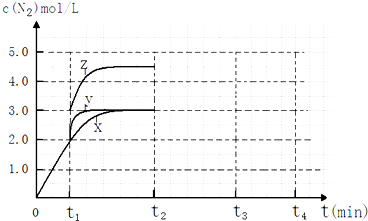
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数--φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2)不变;恒温恒容容器,φ(NO2)变大.
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是加入催化剂.变为曲线Z改变的条件是将容器的体积快速压缩至2L.

②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2-t4内 c(N2)的变化曲线.
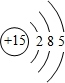 ;
;