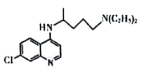
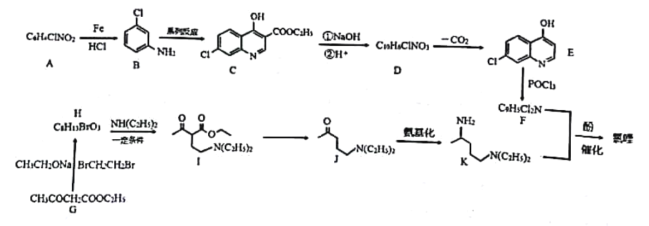
题目内容
【题目】实验室可用氯气和金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,受热易升华。装置如下:
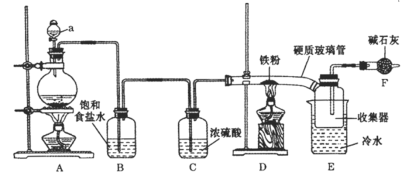
(1)仪器a的名称是____________。
(2)A中反应的离子方程式是__________,D中反应的化学方程式是__________。
(3)反应开始时,先点燃____________处的酒精灯(填“A”或“D”)。
(4)若无B、C两装置,所得产物中可能含有的杂质是_____________(写化学式)。
(5)F中碱石灰的作用是____________(写2点)。
【答案】分液漏斗 ![]()
![]() A FeCl 2、Fe(OH)3、Fe2O3、Fe3O4(写任一种) 吸收多余的氯气,防止污染环境;防止外界空气中的水蒸气进入E,氯化铁潮解
A FeCl 2、Fe(OH)3、Fe2O3、Fe3O4(写任一种) 吸收多余的氯气,防止污染环境;防止外界空气中的水蒸气进入E,氯化铁潮解
【解析】
用氯气和Fe在加热条件下制取无水氯化铁,无水氯化铁易潮解,受热易升华,所以应该用干燥的氯气和Fe制取无水氯化铁,得到的氯化铁应该冷却,A装置是制取氯气,浓盐酸具有挥发性,加热条件下水蒸发导致得到的氯气中含有HCl、水蒸气,用饱和食盐水除去氯气中的HCl,用浓硫酸干燥氯气,所以从C导出的是干燥氯气;D中发生的反应为![]() ,E用于收集FeCl3,F装置干燥空气防止水蒸气进入E而使氯化铁发生水解,同时F还能吸收未反应的氯气,防止污染大气,结合题目分析解答。
,E用于收集FeCl3,F装置干燥空气防止水蒸气进入E而使氯化铁发生水解,同时F还能吸收未反应的氯气,防止污染大气,结合题目分析解答。
(1)从装置图可知,仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)A中浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式为![]() ,D中是铁粉与氯气在加热的条件下反应,其化学方程式为
,D中是铁粉与氯气在加热的条件下反应,其化学方程式为![]() ,故答案为:
,故答案为:![]() ,
, ![]() ;
;
(3)为防止Fe和装置中氧气反应而减少氯化铁的生成,应该先用氯气将整个装置中的空气排出,所以先点燃A装置酒精灯,故答案为:A;
(4)若无B、C两装置,即体系中含有HCl和H2O(g),则可能发生的副反应有:![]() 、
、![]() 、
、![]() 、
、![]() ,故所得产物中可能含有的杂质是FeCl 2、Fe(OH)3、Fe2O3、Fe3O4,故答案为:FeCl 2、Fe(OH)3、Fe2O3、Fe3O4;
,故所得产物中可能含有的杂质是FeCl 2、Fe(OH)3、Fe2O3、Fe3O4,故答案为:FeCl 2、Fe(OH)3、Fe2O3、Fe3O4;
(4)碱石灰具有吸水性,能吸收水蒸气防止空气中的水蒸气进入E装置而使氯化铁发生水解,碱石灰具有碱性,能吸收氯气而防止污染大气,所以碱石灰的作用是:吸收氯气,防止污染环境;防止外界空气中的水蒸气进入E,使氯化铁潮解,故答案为:吸收氯气,防止污染环境;防止外界空气中的水蒸气进入E,使氯化铁潮解。