题目内容
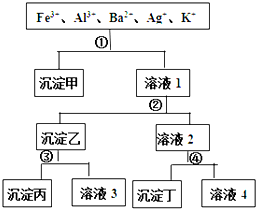 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3?H2O、NaCl四种溶液,按如图所示的步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3?H2O、NaCl四种溶液,按如图所示的步骤分开五种离子.下列判断正确的是( )| A、沉淀乙是氢氧化铝和氢氧化银的混合物 |
| B、溶液3中含有Al3+ |
| C、溶液4含有三种阳离子,分别是H+、Na+、K+ |
| D、试剂①是NaCl,试剂④是H2SO4 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:物质检验鉴别题
分析:Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,Ag+可与H2SO4、NaOH、NH3?H2O、NaCl四种溶液反应生成沉淀,
Fe3+、Al3+可与NaOH、NH3?H2O反应生成沉淀,而Ba2+只与H2SO4反应生成沉淀,加入①时,只产生一种沉淀,故①一定是NaCl,沉淀甲为AgCl;在滤液1中加入②后,生成两种沉淀,故②是NH3?H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3?H2O,③为NaOH,沉淀乙为氢氧化铁和氢氧化镁,沉淀丙为氢氧化镁,溶液3为偏铝酸钠,④为H2SO4,沉淀丁为硫酸钡,溶液4为氯化钠等,以此解答该题.
Fe3+、Al3+可与NaOH、NH3?H2O反应生成沉淀,而Ba2+只与H2SO4反应生成沉淀,加入①时,只产生一种沉淀,故①一定是NaCl,沉淀甲为AgCl;在滤液1中加入②后,生成两种沉淀,故②是NH3?H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3?H2O,③为NaOH,沉淀乙为氢氧化铁和氢氧化镁,沉淀丙为氢氧化镁,溶液3为偏铝酸钠,④为H2SO4,沉淀丁为硫酸钡,溶液4为氯化钠等,以此解答该题.
解答:
解:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.第④步用SO42-将Ba2+和K+分离,
A.沉淀乙是Fe(OH)3和Al(OH)3的混合物,故A错误;
B.溶液3中含有AlO2-,故B错误;
C.因分别加入氨水、氯化钠、硫酸,溶液4含有四种阳离子,分别是H+、Na+、K+、NH4+,故C错误;
D.由以上分析可知试剂①是NaCl,试剂④是H2SO4,故D正确.
故选D.
A.沉淀乙是Fe(OH)3和Al(OH)3的混合物,故A错误;
B.溶液3中含有AlO2-,故B错误;
C.因分别加入氨水、氯化钠、硫酸,溶液4含有四种阳离子,分别是H+、Na+、K+、NH4+,故C错误;
D.由以上分析可知试剂①是NaCl,试剂④是H2SO4,故D正确.
故选D.
点评:本题考查金属阳离子的定性分析,涉及物质的分离和提纯实验方案的设计,题目难度不大,注意根据物质的性质进行实验设计.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
乙醇与乙酸在一定条件下反应生成乙酸乙酯,该反应类型属于( )
| A、加成反应 | B、酯化反应 |
| C、置换反应 | D、复分解反应 |
根据已知条件,对物质的性质强弱判断不正确的是( )
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知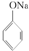 +SO2+H2O→ +SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|
下列反应的离子方程式书写不正确的是( )
| A、小苏打溶液显碱性:HCO3-+H2O═H2CO3+OH- |
| B、FeCl3溶液中滴加过量的氨水:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
| C、CuSO4溶液中滴加过量的氨水:Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O |
| D、向FeSO4溶液中加少量过氧化钠粉末:6H2O+4Na2O2+4Fe2+═4Fe(OH)3↓+O2↑+8Na+ |
金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A、金刚石比石墨稳定 |
| B、1mol石墨比1mol金刚石的总能量低 |
| C、1mol石墨比1mol金刚石的总能量高 |
| D、石墨比金刚石稳定 |
下列说法正确的是( )
| A、干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,Na2O2在这个反应中只做氧化剂 |
| B、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l);△H=-1367.0kJ/mol(燃烧热) |
| C、过量的NaHCO3溶液与Ca(OH)2溶液反应的离子方程式是:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
下列实验操作正确的是( )
| A、给容量瓶检漏时,向容量瓶中注入适量水,左手托住瓶底右食指顶住瓶塞,倒置数次,观察是否漏水 |
| B、具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、配制一定物质的量浓度的溶液时,蒸馏水洗净后容量瓶未干燥,不影响测定结果 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
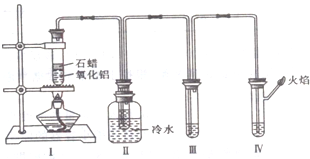
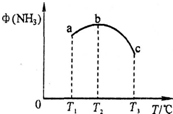 合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产.
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产.