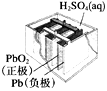
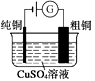
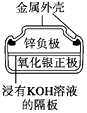
题目内容
【题目】乙烯可用作合成纤维、合成橡胶、合成塑料的原料。回答下列问题:
(1)实验室用乙醇和五氧化二磷制取乙烯的过程如下:
P2O5+3H2O=2H3PO4
H3PO4+C2H5OH→C2H5OPO(OH)2(磷酸单乙醋)+H2O;
170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。
C2H5OPO(OH)2分解反应的化学方程式为。
(2)向2 L的恒容密闭容器中充入0.1mol C2H6和0.1 molCO2 , 发生的反应为
C2H6 (g)+CO2(g) ![]() C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。
C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。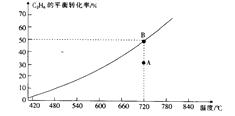
①在相应温度下,A点的反应速率v(正)(填“>”“<”或“=”)v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有 (任写一种)。
③720℃时,上述反应的平衡常数K=。
(3)用CrO3作催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g) ![]() C2H4(g)+H2(g) △H1 ;
C2H4(g)+H2(g) △H1 ;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) △H2 ;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) △H3。
①反应:C2H6(g)+CO2(g) ![]() C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
②已知部分化学键的键能数据如下表所示,则△H1=kJ·mol-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ mol-1 | 348 | 615 | 413 | 436 |
【答案】
(1)C2H5OPO(OH)2![]() CH2=CH2↑+H3PO4
CH2=CH2↑+H3PO4
(2)>,适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案),0.025
(3)![]() ,+123
,+123
【解析】本题主要考查化学平衡的移动。
(1)170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。C2H5OPO(OH)2分解反应的化学方程式为C2H5OPO(OH)2 ![]() CH2=CH2↑+H3PO4。
CH2=CH2↑+H3PO4。
(2)①在相应温度下,A→B平衡向正反应方向建立,所以A点的反应速率v(正)>v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有适当升高温度(或适当减小压强或增大起始时CO2与C2H6的投料比等其他合理答案)。
③720℃时,各物质的平衡浓度为:c(C2H6)=c(CO2)=c(C2H4)=c(CO)=c(H2O)=0.025mol/L,上述反应的平衡常数K= ![]() =0.025。
=0.025。
(3)①将上述热化学方程式分别用a、b、c表示,(3a+b+c)/3得:C2H6(g)+CO2(g) ![]() C2H4(g)+CO2(g)+H2O(g) △H=
C2H4(g)+CO2(g)+H2O(g) △H= ![]() 。
。
②△H=反应物键能之和-生成物键能之和,△H1=(615+6×413-348-4×413-436)kJ·mol-1=+123kJ·mol-1。
【考点精析】关于本题考查的化学平衡移动原理以及影响因素和化学平衡状态的判断,需要了解影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案