��Ŀ����
����Ŀ����������100mL��Cu2+��Al3+��NH4+��H+��Cl������Һ�������Һ����μ���2.5mol/LNaOH��Һ������NaOH ��Һ�������mL����������������ʵ�����mol����ϵ����ͼ��ʾ��

��1��B��ij�����Ļ�ѧʽΪ______________��
��2��ԭ��Һ��Cu2+�����ʵ���Ϊ______��ԭ��Һ��Cl�����ʵ���Ũ��Ϊ________��x-y=__________��
����A��B��C��DΪ��ѧ���������Ҿ�����ͬһ��Ԫ�أ��ת����ϵ��ͼ(��Ӧ���������������Ѿ���ȥ)��
��1����A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ������D��ϡ��Һ��ʹʪ�����ɫʯ����ֽ��졣��D�Ļ�ѧʽΪ___________��
��2����AΪ���ʣ�DΪǿ�������Ԫ�ص�ԭ���������ӵ���ĿС��18��д��C��D�Ļ�ѧ����ʽ��_____________________________________________________________________��
���𰸡� Al��OH��3��Cu��OH��2 0.025mol 0.825mol/L 0.005 HNO3 2Na2O2+2H2O4NaOH+O2��
��������������100mL��Cu2+��Al3+��NH4+��H+��Cl-�����ӵ���Һ�У���μ���2.5molL-1��NaOH��Һ������4mLNaOH��Һʱû�г������ɣ�˵��H+�Ⱥ�NaOH��Ӧ������Һ�к���H+��c(H+)=![]() =0.1mol/L�������μ�NaOH��Һ����������������30mLNaOH��Һ�����μ�NaOH��Һ�����������ʵ������䣬����Һ�к���NH4+����c(NH4+)=
=0.1mol/L�������μ�NaOH��Һ����������������30mLNaOH��Һ�����μ�NaOH��Һ�����������ʵ������䣬����Һ�к���NH4+����c(NH4+)=![]() =0.075mol/L�������μ�NaOH�����������ܽ⣬35mLNaOH�������ܽ⣬˵����Һ�к���Cu2+��Al3+��
=0.075mol/L�������μ�NaOH�����������ܽ⣬35mLNaOH�������ܽ⣬˵����Һ�к���Cu2+��Al3+��
(1)��������������B��ij�����ΪAl(OH)3��Cu(OH)2���ʴ�Ϊ��Al(OH)3��Cu(OH)2��
(2)����Al3++3OH-=Al(OH)3����Al(OH)3+OH-=AlO2-+2H2O֪������������������������ƫ�����������Ҫ�����������֮��Ϊ3��1����������������������ҪNaOH���=(35-33)mL��3=6mL��������������ͭ��ҪNaOH���=(30mL-4mL)-6mL=20mL����c(Cu2+)=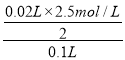 =0.25mol/L��c(Al3+)=
=0.25mol/L��c(Al3+)=![]() =0.05mol/L��ԭ��Һ��n(Cu2+)=0.25mol/L��0.1L=0.025mol����Һ�д��ڵ���غ㣬���ݵ���غ��3c(Al3+)+2c(Cu2+)+c(NH4+)+c(H+)=c(Cl-)=[3��0.05+2��0.25+0.075+0.1]mol/L=0.825mol/L��x-y= n[Al(OH)3] =n(Al3+)=
=0.05mol/L��ԭ��Һ��n(Cu2+)=0.25mol/L��0.1L=0.025mol����Һ�д��ڵ���غ㣬���ݵ���غ��3c(Al3+)+2c(Cu2+)+c(NH4+)+c(H+)=c(Cl-)=[3��0.05+2��0.25+0.075+0.1]mol/L=0.825mol/L��x-y= n[Al(OH)3] =n(Al3+)= ![]() =0.005mol���ʴ�Ϊ��0.025mol��0.825mol/L��0.005��
=0.005mol���ʴ�Ϊ��0.025mol��0.825mol/L��0.005��
����(1)��A��ˮ��Һ��ʹʪ��ĺ�ɫʯ����ֽ��������AΪNH3��D��ϡ��Һ��ʹʪ�����ɫʯ����ֽ��죬D�����ԣ���BΪNO��CΪNO2��DΪHNO3���ʴ�Ϊ��HNO3��
(2)��AΪ���ʣ�DΪǿ�������Ԫ�ص�ԭ���������ӵ���ĿС��18����AΪNa��BΪNa2O��CΪNa2O2��DΪNaOH��C��D�Ļ�ѧ����ʽ��2Na2O2+2H2O�T4NaOH+O2�����ʴ�Ϊ��2Na2O2+2H2O�T4NaOH+O2����

����Ŀ������˵����ȷ���ǣ� ��
A.��100�桢101kPa�����£�Һ̬ˮ��������Ϊ40.69kJmol��1 �� ��H2O��g��H2O��l���ġ�H=40.69kJmol��1
B.�����£���0.10molL��1��NH3H2O��Һ�м�������NH4Cl���壬��ʹNH3H2O�ĵ���Ƚ��ͣ���Һ��pH��С
C.��֪��
���ۼ� | C��C | C=C | C��H | H��H |
����/kJmol��1 | 348 | 610 | 413 | 436 |
��Ӧ 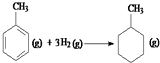 ���ʱ�Ϊ��H=[��4��348+3��610+8��413��+3��436����7��348+14��413��]kJmol��1=��384kJmol��1
���ʱ�Ϊ��H=[��4��348+3��610+8��413��+3��436����7��348+14��413��]kJmol��1=��384kJmol��1
D.��֪MgCO3��Ksp=6.82��10��6 �� �����к��й���MgCO3����Һ�У�����c��Mg2+��=c��CO32��������c��Mg2+��c��CO32����=6.82��10��6
����Ŀ��5�ֹ�������A��B��C��D��E�ɱ��в�ͬ������������ɣ����Ǿ�������ˮ��
������ | Na+�� Al3+Fe3+�� Cu2+��Ba2+ |
������ | OH����Cl����CO32����NO3����SO4�� |
�ֱ�ȡ���ǵ�ˮ��Һ����ʵ�飬������£���A��Һ��C��Һ��Ϻ������ɫ��������ó����м�������ϡHNO3 �� ���������ܽ⣬ʣ���ɫ���壻��B��Һ��E��Һ��Ϻ�������ɫ������ͬʱ�����������壻
������C��Һ��D��Һ��Ϻ������ɫ����������C��Һ��D��Һ��Ϻ�������
��B��Һ��D��Һ��Ϻ�������
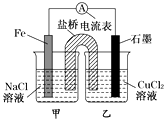
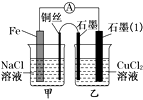
�ݽ�38.4g CuƬͶ��װ������D��Һ���Թ��У�CuƬ���ܽ⣬�ٵμ�1.6molL��1ϡH2SO4 �� Cu���ܽ⣬�ܿڸ����к���ɫ������֣�
��1���ݴ��ƶ�A��C�Ļ�ѧʽΪ��A��C ��
��2��д��������з�����Ӧ�Ļ�ѧ����ʽ ��
��3��D��Һ�е���ʯ����Һ�������� �� ԭ�����������ӷ���ʽ˵������
��4�����������Ҫ��CuƬ��ȫ�ܽ⣬���ټ���ϡH2SO4�������mL��
��5������500mL 3molL��1��E��Һ�������11.2L CO2���壨��״�� �£�����Ӧ����Һ�и����ӵ�������Ũ����С�����˳��Ϊ ��
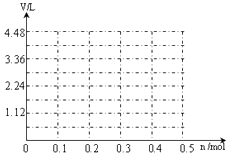
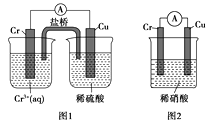
��6�����ö��Ե缫���A��B�Ļ����Һ�����ʵ����ʵ�����Ϊ0.1mol����������ϵ�л���ͨ�����������������������״���£�V��ͨ�����ӵ����ʵ���n�Ĺ�ϵ����������������ˮ����