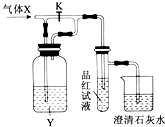
题目内容
【题目】A,B,C,D,E,F六种元素的原子序数依次递增.己知: ①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,另外五种元素均为短周期主族元素;②A,C原子p轨道的电子数分别为2和4;③D原子最外层电子数为偶数;④E原子价电子(外围电子)排布为msnmpn﹣1 . 请回答下列问题:
(1)下列叙述正确的是(填序号).
A.金属键的强弱:D>E
B.基态原子第一电离能:D>E
C.六种元素中,电负性最大的元素是E
D.晶格能:NaCl<DCl2
(2)F基态原子的核外电子排布式为;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为(填元素符号).
(3)A与C形成的非极性分子,该分子与过量强碱反应生成的酸根离子的空间构型为 .
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同,N 3﹣中心原子的杂化轨道类型为 .
【答案】
(1)BD
(2)1s22s22p63s23p63d104s1;Cr
(3)平面三角形
(4)sp
【解析】解:A,B,C,D,E,F六种元素的原子序数依次递增,除F元素外,其余的均为短周期主族元素.①已知F为第四周元素,除最外层只有一个电子外,其他各层上均填满电子,则F为铜元素;②A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2 , 则A为碳元素;C核外电子排布式为1s22s22p4 , 则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;③E原子价电子(外围电子)排布为msnmpn﹣1 , s能级容纳2个电子,则E外围电子排布为ms2mp1 , 原子序数大于氧元素,则E为铝元素.④D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素;(1)A,D为Mg,E为Al,铝离子半径小于镁离子半径,金属键的强弱:D<E,故A错误B.同周期自左而右基态原子第一电离能增大,但是第IIA与第IIIA族反常,则基态原子第一电离能:D>E,故B正确;C.六种元素中,电负性最大是氧元素,即C的电负性最强,故C错误;D.晶格能的大小:电荷越高,晶格能越大;离子半径越小,晶格能越大;镁离子半径小于钠离子半径,而镁离子所带电荷大于钠离子所带电荷,故晶格能:NaCl<MgCl2 , 故D正确;所以答案是:BD;(2)F为同元素,核外电子数位29,核外电子排布式是1s22s22p63s23p63d104s1;与F同一周期的元素中基态原子轨道上成单电子数最多的元素为Cr,其核外电子排布式是1s22s22p63s23p63d54s1 , 含有6个单电子;所以答案是:1s22s22p63s23p63d104s1;Cr;(3)A为碳元素,C为氧元素,形成的非极性分子二氧化碳,该分子与过量强碱反应生成的酸根离子,为CO32﹣ , 碳原子的价层电子对数3+ ![]() (4+2﹣2×3)=3,空间构型是平面三角形;所以答案是:平面三角形;(4)N3﹣ 与CO2互为等电子体,O=C=O中含有2个C﹣O键,形成2条杂化轨道,采用sp杂化; 所以答案是:sp.
(4+2﹣2×3)=3,空间构型是平面三角形;所以答案是:平面三角形;(4)N3﹣ 与CO2互为等电子体,O=C=O中含有2个C﹣O键,形成2条杂化轨道,采用sp杂化; 所以答案是:sp.

【题目】下列说法正确的是( )
A.在100℃、101kPa条件下,液态水的气化热为40.69kJmol﹣1 , 则H2O(g)H2O(l)的△H=40.69kJmol﹣1
B.常温下,在0.10molL﹣1的NH3H2O溶液中加入少量NH4Cl晶体,能使NH3H2O的电离度降低,溶液的pH减小
C.已知:
共价键 | C﹣C | C=C | C﹣H | H﹣H |
键能/kJmol﹣1 | 348 | 610 | 413 | 436 |
则反应 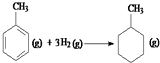 的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
的焓变为△H=[(4×348+3×610+8×413)+3×436﹣(7×348+14×413)]kJmol﹣1=﹣384kJmol﹣1
D.已知MgCO3的Ksp=6.82×10﹣6 , 则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)c(CO32﹣)=6.82×10﹣6