题目内容
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。( )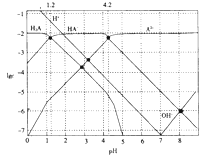
下列说法不正确的是
A.H2A是二元弱酸
B.HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C.0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
【答案】B
【解析】A. 溶液中存在H2A、H+、HA-、A2-,说明H2A是二元弱酸,故A不符合题意;
B. HA-![]() H++A2-的电离平衡常数Ka=
H++A2-的电离平衡常数Ka= ![]() =c(H+)=10-4.2,故B符合题意;
=c(H+)=10-4.2,故B符合题意;
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-),故C不符合题意;
D. 由图可知pH=4.2时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-),故D不符合题意。
故答案为:B
根据二元酸溶液中存在的离子判断其为弱酸,结合图中的数据判断溶液中离子浓度大小等即可.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目